Ångtrycksdiagram
Hej,
Jag behöver hjälp med följande uppgift (b):

Jag har lite problem med att läsa av pB och pA för att kunna beräkna bland annat aktivitetskoefficienterna, jag fick fram att enligt diagrammet så är pA ungefär 4,5 mmHg och pB är 5,6. Jag vet dock inte om det stämmer. Skulle någon vilja förklara hur man egentligen ska läsa av detta, känner mig osäker kring hur man gör.
Tack på förhand :)
Tråden flyttad från Fysik>Universitet till Kemi>Universitet. /Teraeagle, moderator
Skulle du kunna ladda upp diagrammet igen? Det tycks ha dykt upp någon bugg som gör att bilden inte visas:

Bild på diagrammet:

De streckade linjerna visar sambandet mellan molbråket och partialtrycket för de två ämnena om de hade följt Raoults lag. Den är dock bara giltig vid höga molbråk av det ena ämnet (blåmarkerade områden). Om ämnet istället har väldigt låg koncentration gäller Henrys lag (rödmarkerade områden). I båda dessa fall innehåller lösningarna väldigt mycket av en komponent och då har de ideala beteenden.
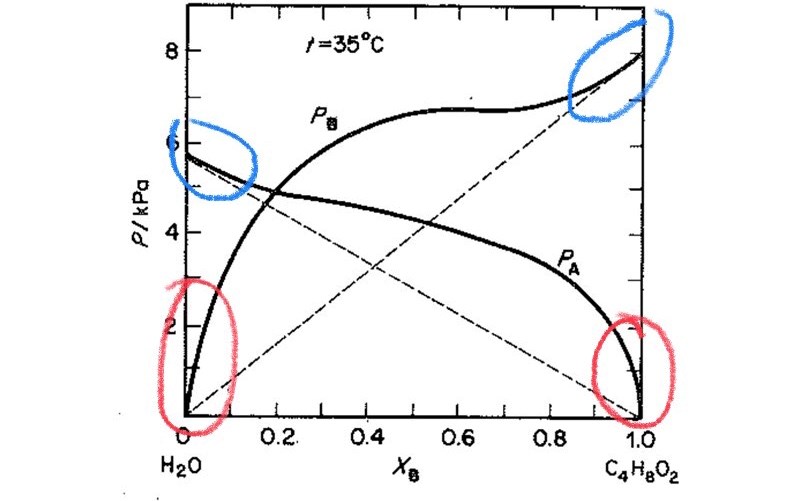
Om ångtrycket av en komponent vid ett visst molbråk blir högre än vad som förutspås av Raoults lag säger man att det är en positiv avvikelse. Om ångtrycket istället är lägre kallas det för negativ avvikelse. Vilket gäller i detta fall?
I b-uppgiften behöver du först bestämma molbråket av dioxan. Sedan går du lodrätt upp till de två kurvorna för respektive ämne och läser av y-värdet (ångtrycket).
För att bestämma aktivitetskoefficienten () för respektive ämne använder du ekvationen
som är en modifierad version av Raoults lag som gäller även vid icke-ideala förhållanden, där är partialtrycket och är mättnadsångtrycket.
I a) är det väll positiv avvikelse, alltså exoterm reaktion.
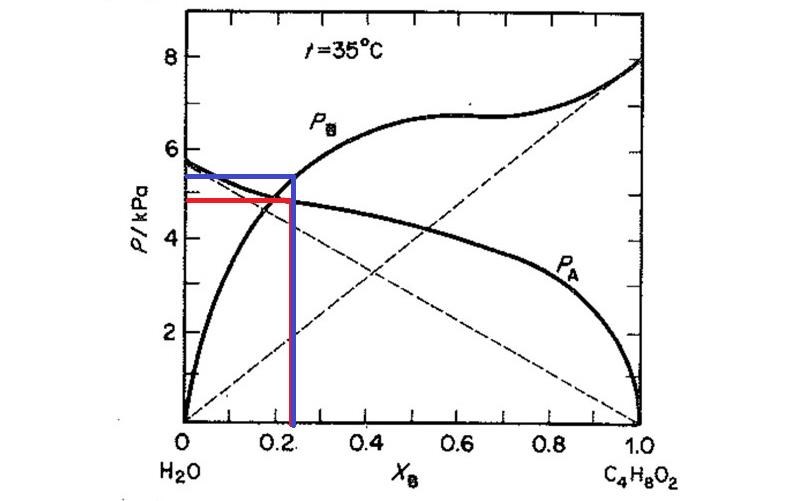
Målbråket blev 0,23. Stämmer det då att pA=5,1 och pB= 4,8?
Det står kPa, måste jag då göra om det till mmHg eller kan jag räkna vidare med kPa? Vilka enheter ska jag räkna med egentligen?
Japp, det är en positiv avvikelse. Det betyder att vatten och dioxan inte binder lika starkt till varandra som till "sig självt". Det kostar alltså mer energi att bryta bindningar mellan vatten-vatten och dioxan-dioxan än man får ut av att skapa vatten-dioxan-bindningar. Då förångas ämnena lättare från blandningen vilket ger det högre ångtrycket (positiv avvikelse). Blandningen av vatten och dioxan är med andra ord inte exoterm, utan..?
I figuren nedan ser du hur man ska läsa av grafen. För vatten (A) kommer ångtrycket att vara strax under 5 kPa, säg 4,8 kPa. Det betyder att om man börjar koka en dioxan-vatten-blandning vid 35 grader där molbråket dioxan är 0,23 kommer ångan som bildas att innehålla vattenånga med partialtrycket 4,8 kPa.
Då är den alltså endoterm, då förstår jag. Jag skulle också ange vilken standardtillstånd mina värden är passerade på lösningsmedel, stämmer det eller tänker jag fel?
Du har inte räknat något än så det är svårt att säga vilket standardtillstånd du har använt.
Räknar man det genom att ta alfa dividerat med gamma (för b)?
Vilka enheter ska gamma och alfa ha då?
Du ska använda formeln som jag skrev i ett tidigare inlägg. Gör en enhetsanalys så ser du vilket värde gamma (aktivitetskoefficienten) ska ha.
Är det inte följande formel :

Där jag bara löser ut C, sen undrar jag också- menar de att jag ska ta gamma dividerad med koncentrationen?
Koncentrationen räknar jag genom att n/v och volymen får jag fram genom att multiplicera densitet och massan.
Teraeagle skrev:Du ska använda formeln som jag skrev i ett tidigare inlägg. Gör en enhetsanalys så ser du vilket värde gamma (aktivitetskoefficienten) ska ha.
Teraeagle skrev:Teraeagle skrev:Du ska använda formeln som jag skrev i ett tidigare inlägg. Gör en enhetsanalys så ser du vilket värde gamma (aktivitetskoefficienten) ska ha.
Jag har räknat ut båda gamma och A blev 1,10 och b ungefär 2,82. Det blir inga enheter eftersom de tar ut varandra. Det betyder att vi har mer av B, men jag förstår inte hur jag ska bestämma standardtillståndet utifrån det. Är standardtillståndet för icke ideala lösningsmedel? Jag förstår inte ska man räkna fram standardtillståndet eller kan man se det utifrån värdet på gamma
Standardtillståndet blir väl och . Det är det villkor som gäller för att aktiviteterna av respektive ämne ska bli 1. Det är väl så man får tänka.
Aha, så det räcker med svarar standardtillståndet är Xa=1 respektive Xb=1.


