Beräkna syrakonstanten
Hej!
Min uppgift lyder som följande:
Man önskar bestämma syrakonstanten för en organisk syra: HA + H20 <-- --> H30+ + A-
Man löser 0,400 mol av syran i så mycket vatten att lösningens volym blir 2,00 dm3. Lösningens pH-värde uppmättes till 2,75. Beräkna syrakonstanten.
Svaret ska bli 1,6*10-5 mol/dm3
Denna uppgift diskuterades i tidigare trådar:
https://gamla.pluggakuten.se/forumserver/viewtopic.php?id=120173&id=120173
https://gamla.pluggakuten.se/forumserver/viewtopic.php?id=65919
Ändå så får jag inte rätt svar... Vad gör jag fel?
Med hjälp av pH så har jag först räknat ut [H+] = 10-2,75 = 0,0017
Jag har ställt upp en tabell:
HA H3O+ + A-
Före 0,4 0 0
Änd 0,4-0,0017 +0,0017 +0,0017
Jämv 0,3983 0,0017 0,0017
Volym 0,3983/2 0,0017/2 0,0017/2
Vad gör jag fel? :D
Du räknar med fel koncentration på syran före protolys. Du har 0.400mol av syran i volymen 2,00 dm3. Vilken blir koncentrationen?
Med formeln c=n/V får jag för koncentrationen
c = 0,4/2
c = 0,2
Före är det alltså 0,2, förändringen är 0,2-0,0017, vid jämvikten är det 0,1983 och med volymen blir det 0,1983.
Men det får mig fortfarande inte till rätt resultat?
Varför delar du koncentrationerna för oxoniumjonerna och anjonerna med 2? Det du får fram när du räknar om pH-värdet är ju en koncentration, inte en substansmängd.
Hej!
Det gjorde jag nog för att det alltid är det sista steget när man beräknar kemisk jämvikt. Så jag kopierade bara därifrån utan att tänka! Så bra att du påpekade det.
Eftersom jag beräknade koncentrationen på syran så antar jag inte ska dela den med två heller?
Insåg också att jag hade rundat fel på koncentrationerna för oxoniumjonerna och anjonerna. Nu får jag rätt resultat! Tack så mycket för din tålmodiga hjälp!!!
Det gjorde jag nog för att det alltid är det sista steget när man beräknar kemisk jämvikt.
Menar du att du delade med volymen, som var 2,00 liter, så som du skulle ha gjort om det hade varit substansmängder och inte koncentrationer?
Precis. Jag övade på följande uppgifter innan:
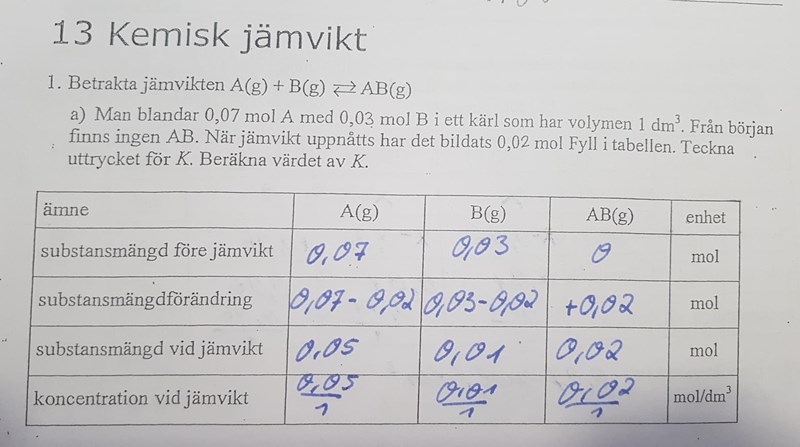
Där var sista steget alltid att dela med volymen, vilket jag gjorde även för den här uppgiften, troligen för att tabellerna liknar varandra, utan att fundera över ifall det är koncentrationer eller substansmängder som utgångspunkt. Men nu vet jag bättre (hoppas jag, tenta om 4 timmar!).
Jag håller tummarna!


