Beräkningar
Du har en ballong som är fylld med lustgas, dikväveoxid, N2O. Lustgasen i ballongen har massan 10 g. Du släpper ut lustgasen ur ballongen så att den blir tom. Nu fyller du ballongen med metangas, CH4, så att du har lika många metangasmolekyler som det fanns lustgasmolekyler. Hur massa har metangasen i ballongen?
Uppgiften har att göra med massa/volym för N2O, som sedan anger hur stor volym CH4 som får plats - och från denna volym kan du få fram massan.
Börja med att visa hur långt du kommit med ditt svar, så kan vi hjälpa dig vidare med svaret.
mag1 skrev:Uppgiften har att göra med massa/volym för N2O, som sedan anger hur stor volym CH4 som får plats - och från denna volym kan du få fram massan.
Börja med att visa hur långt du kommit med ditt svar, så kan vi hjälpa dig vidare med svaret.
Jag trodde att massan för CH4 är samma som massan för N2O. Men svaret var fel och jag vet inte varför. Undrar om du kan hjälpa mig med att få rätt svaret! Tack så mycket :D 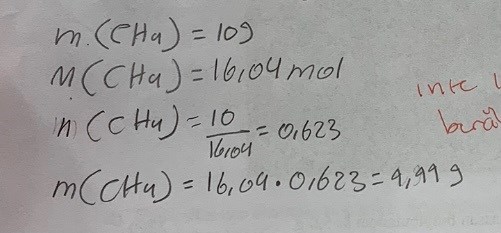
Nej massan är inte densamma för de två olika kemiska föreningarna. Det gör att molmassan inte är lika stor heller. Och det är sambandet mellan massa, substansmängd och molmassa som du behöver använda.
Det enda du vet ur uppgiften är massan (m) av kvävedioxiden 10g. Molmassan (M) för kvävedioxid kan du få fram genom att summera massorna av alla atomer i denna molekyl. Och med m och M kan du räkna ut antalet kvävedioxidmolekyler, eller antalet mol (n) av kvävedioxid som det finns i uppgiften.
Och uppgiften anger att:
Nu fyller du ballongen med metangas, CH4, så att du har lika många metangasmolekyler som det fanns lustgasmolekyler.
Och då antalet molekyler är det samma (antalet mol), så kan du med molmassan för metangas räkna ut hur mycket detta antal mol metangas väger. Och det är denna massa som är svaret på din fråga.

