Bestäm massa
Hej
På uppgift 7,37 så vet jag inte hur jag ska göra riktigt.

Jag har påbörjat, men hur ska jag göra?
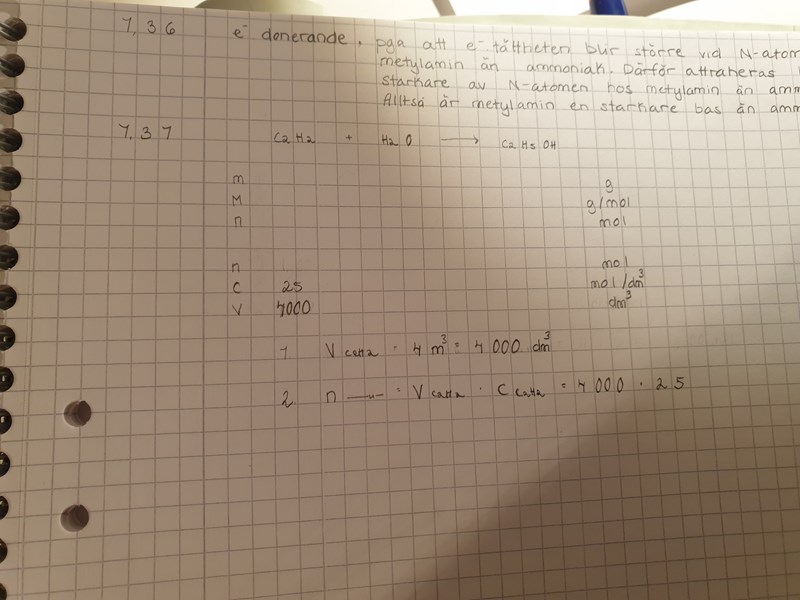
Tack i förväg!
Börja med att räkna ut hur många mol etyn som finns i volymen 4 m3 (uppgiften anger hur stor volym en mol etyn upptar). Då vet du hur många mol acetaldehyd som kan bildas, men utbytet är lägre än 100%. Efter att ha korrigerat antalet mol för utbytet vid denna reaktion, kan vet du hur många mol etanol som kan bildas - som du får räkna om till massa.
mag1 skrev:Börja med att räkna ut hur många mol etyn som finns i volymen 4 m3 (uppgiften anger hur stor volym en mol etyn upptar). Då vet du hur många mol acetaldehyd som kan bildas, men utbytet är lägre än 100%. Efter att ha korrigerat antalet mol för utbytet vid denna reaktion, kan vet du hur många mol etanol som kan bildas - som du får räkna om till massa.
Är det 100.000 mol?
Totyn skrev:mag1 skrev:Börja med att räkna ut hur många mol etyn som finns i volymen 4 m3 (uppgiften anger hur stor volym en mol etyn upptar). Då vet du hur många mol acetaldehyd som kan bildas, men utbytet är lägre än 100%. Efter att ha korrigerat antalet mol för utbytet vid denna reaktion, kan vet du hur många mol etanol som kan bildas - som du får räkna om till massa.
Är det 100.000 mol?
Nej. Visa steg för steg hur du har räknat, så kan vi hjälpa dig att hitta var det har blivit fel.
Nej du har snurrat till enheterna tror jag och multiplicerat dem med varandra...
Hur många dm3 går det på i m3?
1 dm = 10 cm.
1 dm3 = 10 x 10 x 10 cm
1 m3 = 1 x 1 x 1 m, eller 100 x 100 x 100 cm.
Ja, men 4000 × 25 = 100.000
Totyn skrev:Ja, men 4000 × 25 = 100.000
Det är alltid bra att ta med enheterna så går det lättare att undvika att det går snett.
4000 dm3 är volymen eten.
Varje mol eten har volymen 25 dm3, d.v.s
1 mol = 25 dm3
Om kan inte multiplicerar totalvolymen eten med molvolymen, det blir nästan som att multiplicera molmassan (M) med massan (g) för att få fram substansmängden - istället för att dividera massan (m) med molmassan (M).
1 mol eten har volymen 25 dm3. Så hur många mol får då plats i den volymen 4000 dm3...
mag1 skrev:Totyn skrev:Ja, men 4000 × 25 = 100.000
Det är alltid bra att ta med enheterna så går det lättare att undvika att det går snett.
4000 dm3 är volymen eten.
Varje mol eten har volymen 25 dm3, d.v.s
1 mol = 25 dm3
Om kan inte multiplicerar totalvolymen eten med molvolymen, det blir nästan som att multiplicera molmassan (M) med massan (g) för att få fram substansmängden - istället för att dividera massan (m) med molmassan (M).
1 mol eten har volymen 25 dm3. Så hur många mol får då plats i den volymen 4000 dm3...
160
Reaktionsformeln känns fortfarande inte rätt. För att ställa upp så vill jag ju skriva hela formeln, men vad är det aldehyden reagerar med som blir etanol?
Bra då har du antalet mol, men enheten saknas.
Hur långt har du kommit med formeln? Visa!
Titta på acetaldehyden, vad behöver sken för att aldehydgruppen skall bilda en alkohol istället?
mag1 skrev:Bra då har du antalet mol, men enheten saknas.
Hur långt har du kommit med formeln? Visa!
Titta på acetaldehyden, vad behöver sken för att aldehydgruppen skall bilda en alkohol istället?

Jag vet inte vad den ska reagera med och vilken/ Vilka andra produkter som bildas
Inga andra produkter behöver bildas.
Men summaformlerna ser konstiga ut.
Skriv ut strukturformlerna, och ta med alla steg så blir det nog klarare vad som behöver reagera med acetaldehyden (X nedan) för att bilda etanol.
eten +H2O => acetaldehyd + X => etanol
mag1 skrev:Inga andra produkter behöver bildas.
Men summaformlerna ser konstiga ut.
Skriv ut strukturformlerna, och ta med alla steg så blir det nog klarare vad som behöver reagera med acetaldehyden (X nedan) för att bilda etanol.
eten +H2O => acetaldehyd + X => etanol
Är inte acetaldehyden CH3CHO och etanol C2H5OH
Ja formeln för acetaldehyd är som du skrev C2H4O.
Det brukar vara enklare att se om man tittar på strukturformlerna. Men det går med de summaformler du skrev.
Vad behöver ske med acetaldehyden för att den skall bilda etanol C2H5OH? Vad behöver tillföras?
För detta andra steg anger inte uppgiften hur det sker, men det är inte heller så viktigt, då du redan vet utbytet av samtliga steg från uppgiften. Så du kan räkna ut massan etanol som kan bildas.
mag1 skrev:Ja formeln för acetaldehyd är som du skrev C2H4O.
Det brukar vara enklare att se om man tittar på strukturformlerna. Men det går med de summaformler du skrev.
Vad behöver ske med acetaldehyden för att den skall bilda etanol C2H5OH? Vad behöver tillföras?
För detta andra steg anger inte uppgiften hur det sker, men det är inte heller så viktigt, då du redan vet utbytet av samtliga steg från uppgiften. Så du kan räkna ut massan etanol som kan bildas.
Är det H2?
Ja, vätgas går bra med rätt katalysator.
I naturen bildas acetaldehyden av enzymet alkoholdehydrogenas, genom oxidation av etanol och reduktion av NAD+.
Jag har en till fråga om utbytet. När räknar jag med den? För jag testade att räkna 65% av volymen, substansmängden och massan och fick samma resultat på alla
Totyn skrev:Jag har en till fråga om utbytet. När räknar jag med den? För jag testade att räkna 65% av volymen, substansmängden och massan och fick samma resultat på alla
Ja det är väl väntat?
Volymen eten är direkt proportionell mot; 1) substansmängden och 2) massan.
Antalet partiklar som kan omvandlas är 65%, vilket kan beskrivas i den volym dessa partiklarna upptar, eller antalet partiklar, eller massan av dessa partiklarna.
mag1 skrev:Totyn skrev:Jag har en till fråga om utbytet. När räknar jag med den? För jag testade att räkna 65% av volymen, substansmängden och massan och fick samma resultat på alla
Ja det är väl väntat?
Volymen eten är direkt proportionell mot; 1) substansmängden och 2) massan.
Antalet partiklar som kan omvandlas är 65%, vilket kan beskrivas i den volym dessa partiklarna upptar, eller antalet partiklar, eller massan av dessa partiklarna.
Så om molförhållandet inte hade varit jämt så bör jag räkna med utbyte efter att jag har räknat ut det eller?
- Räkna ut hur mycket av produkten som bildas om utbytet är 100 %. Det kan vara kg, mol eller något annat.
- Multiplicera med utbytet, d v s med 0,65 i det här fallet
Förmodligen blandar du ihop det lite med situationen Man vill framställa 100 g av en viss förening, men utbytet är bara 50 %. Hur mycket skall man ta av reaktanten?". I denna situation behöver man dividera med utbytet istället.
Det är ganska logiskt egentligen. Om man vet hur mycket man har från början, skall det bli mindre än om utbytet hade varit 100 %. Då multiplicerar man med något som är mindre än 1, nämligen utbytet. Om man vet hur mycket det skall bildas, måste man ha extra mycket utgångsmaterial, så då multiplicerar man med något som är större än 1, nämligen 1/utbytet.
Smaragdalena skrev:
- Räkna ut hur mycket av produkten som bildas om utbytet är 100 %. Det kan vara kg, mol eller något annat.
- Multiplicera med utbytet, d v s med 0,65 i det här fallet
Förmodligen blandar du ihop det lite med situationen Man vill framställa 100 g av en viss förening, men utbytet är bara 50 %. Hur mycket skall man ta av reaktanten?". I denna situation behöver man dividera med utbytet istället.
Det är ganska logiskt egentligen. Om man vet hur mycket man har från början, skall det bli mindre än om utbytet hade varit 100 %. Då multiplicerar man med något som är mindre än 1, nämligen utbytet. Om man vet hur mycket det skall bildas, måste man ha extra mycket utgångsmaterial, så då multiplicerar man med något som är större än 1, nämligen 1/utbytet.
Aha, tack


