Bestämning av en svag syras och en svag bas konstant och protolysgrad genom titrering
Jag har en laboration där man ska göra vad det står i rubriken. Jag kommer inte ihåg hur man gjorde allting från kemi 1 med att bestämma koncentrationen av en syra/bas genom titrering.
Syftet med labben:
Syftet med denna laboration är först att bestämma koncentrationen av en svag syra med hjälp av en tritrerkurva men även en svag syras Ka-värdet och protolysgrad. Detta görs i denna laboration genom att titrera ättiksyra med natriumhydroxidlösning. Under tiden som titratorn tillsätts i små volymer mäts pH:t med pH-meter. Efter titreringen görs en graf för den titrerade ättiksyran. Med hjälp av grafen bestäms sedan de tre värdena experimentellt.
Behöver hjälp med hur man ska tänka när man ska bestämma de värderna, och hur beräkningen ska ser ut! Jag har inte varit så aktiv i lektionerna så förstår inte riktigt vad Ka-värdet är eller vad pKa-värdet är.
Välkommen till Pluggakuten!
Har du gjort en titrerkurva? I så fall, lägg in en bild av den här. Om inte, gör en titrerkurva och lägg in den här.
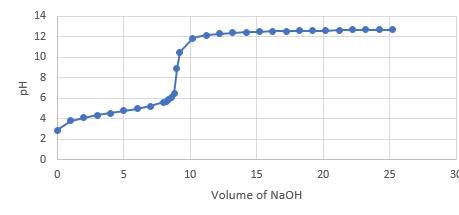
Det här är titreringskurvan. Är inte NaOH en stark bas?
Jovisst, NaOH är en stark bas. Man väljer att titrera den svaga syran med en stark bas, för om man skulle titrera den med en svag bas skulle allting bli krångligare.
Hur många ml NaOH har man tillsatt vid ekvivalenspunkten?
vad är formelerna för att räkna ut pka eller pkb?
Johnmaltessons skrev:10 ml
Nej, ekvivalenspunkten är inte 10 ml. Ekvivalenspunkten är där kurvan stupar som brantast. Hur mäånga ml NaOH har man tillsatt vid ekvivalenspunkten?
Johnmaltessons skrev:10 ml
Nej, ekvivalenspunkten är inte 10 ml. Ekvivalenspunkten är där kurvan stupar som brantast. Hur många ml NaOH har man tillsatt vid ekvivalenspunkten? Du kan inte börja beräkna pKa förrän du har fått fram en korrekt ekvivalenspunkt
jaha, så ungefär 9 ml då eller?
9 ml ser ut att vara ett rimligt värde för ekvivalenspunkten.
Har du lärt dig uttrycket för Ka? Skriv det i så fall, och förklara hur mycket du har förstått om vad det innebär! Då vet jag hur jag skall fortsätta förklaringen, och inte gå in på en massa som du redan vet.
Ka är väll jämviktskonstanten för en syra så om balanserad ekvation ser ut så här CH3COOH + NaOH → CH3COONa + H2O
så är ka =[CH3COONA]/[CH3COOH][NaOH] man tar inte hänsyn till vattten tror jag.
Nästan rätt - natriumjonen skall inte vara med i varken i reaktionsformeln eller uttrycket för syrakonstanten.
Ett sätt att se pKa är som "det pH-värde det är när koncentraionen av syran och dess korresponderande bas är lika". Detta gör att man kan läsa av pKa i en titrerkurva som "det pH-värde det är när man har tillsatt hälften så mycket av basen som vid ekvivalenspunkten". Är detta begripligt, eller behöver du en utförligare förklaring för hur man hittar sitt pKa-värde med hjälp av titrerkurvan?
Nej det är en bra förklaring men om syran och dess korresponderande bas är lika blir de inte 1 eller nåt. Så i syrakostanten man ska bara har med reaktanterna och dess korresponderande bas eller?
men för att hitta ka, måste jag hitta vad koncentration av ättiksyra är först eller?
Johnmaltessons skrev:Nej det är en bra förklaring men om syran och dess korresponderande bas är lika blir de inte 1 eller nåt. Så i syrakostanten man ska bara har med reaktanterna och dess korresponderande bas eller?
Skriv upp uttrycket för Ka. Sätt in att [HA]=[A-] och beräkna pH-värdet för denna lösning. Jämför det med pKa för syran.
Johnmaltessons skrev:men för att hitta ka, måste jag hitta vad koncentration av ättiksyra är först eller?
Värdet på pKa påverkas inte av koncentrationen - pKa är ju en konstant.
Smaragdalena skrev:Johnmaltessons skrev:Nej det är en bra förklaring men om syran och dess korresponderande bas är lika blir de inte 1 eller nåt. Så i syrakostanten man ska bara har med reaktanterna och dess korresponderande bas eller?
Skriv upp uttrycket för Ka. Sätt in att [HA]=[A-] och beräkna pH-värdet för denna lösning. Jämför det med pKa för syran.
vad? om Ka är [CH3COONA]/[CH3COOH][NaOH] och [CH3COO-]=[CH3COOH] så blir ka = [NaOH]
Smaragdalena skrev:Nästan rätt - natriumjonen skall inte vara med i varken i reaktionsformeln eller uttrycket för syrakonstanten.
Ett sätt att se pKa är som "det pH-värde det är när koncentraionen av syran och dess korresponderande bas är lika". Detta gör att man kan läsa av pKa i en titrerkurva som "det pH-värde det är när man har tillsatt hälften så mycket av basen som vid ekvivalenspunkten". Är detta begripligt, eller behöver du en utförligare förklaring för hur man hittar sitt pKa-värde med hjälp av titrerkurvan?
Då är pka vid 4,5 ml som är ungefär vid 4,3 ph men hur omvandla man det till pKa? det finns ett sätt eller även om det är en konstant för varje syra
Johnmaltessons skrev:Smaragdalena skrev:Johnmaltessons skrev:Nej det är en bra förklaring men om syran och dess korresponderande bas är lika blir de inte 1 eller nåt. Så i syrakostanten man ska bara har med reaktanterna och dess korresponderande bas eller?
Skriv upp uttrycket för Ka. Sätt in att [HA]=[A-] och beräkna pH-värdet för denna lösning. Jämför det med pKa för syran.
vad? om Ka är [CH3COONA]/[CH3COOH][NaOH] och [CH3COO-]=[CH3COOH] så blir ka = [NaOH]
Du behöver inte sätta in Ka för någon särskild syra. Vilket värde har om [HA]=[A-]?Vad blir det kvar av Ka i så fall?
EDIT: fixade LaTeX
Johnmaltessons skrev:Smaragdalena skrev:Nästan rätt - natriumjonen skall inte vara med i varken i reaktionsformeln eller uttrycket för syrakonstanten.
Ett sätt att se pKa är som "det pH-värde det är när koncentraionen av syran och dess korresponderande bas är lika". Detta gör att man kan läsa av pKa i en titrerkurva som "det pH-värde det är när man har tillsatt hälften så mycket av basen som vid ekvivalenspunkten". Är detta begripligt, eller behöver du en utförligare förklaring för hur man hittar sitt pKa-värde med hjälp av titrerkurvan?
Då är pka vid 4,5 ml som är ungefär vid 4,3 ph men hur omvandla man det till pKa? det finns ett sätt eller även om det är en konstant för varje syra
Man räknar om mellan pKa och Ka på precis samma sätt som mellan pH och [H3O+].
Smaragdalena skrev:Johnmaltessons skrev:Smaragdalena skrev:Johnmaltessons skrev:Nej det är en bra förklaring men om syran och dess korresponderande bas är lika blir de inte 1 eller nåt. Så i syrakostanten man ska bara har med reaktanterna och dess korresponderande bas eller?
Skriv upp uttrycket för Ka. Sätt in att [HA]=[A-] och beräkna pH-värdet för denna lösning. Jämför det med pKa för syran.
vad? om Ka är [CH3COONA]/[CH3COOH][NaOH] och [CH3COO-]=[CH3COOH] så blir ka = [NaOH]
Du behöver inte sätta in Ka för någon särskild syra. Vilket värde har $$\frac{[HA]}[A^-]}$$ om [HA]=[A-]?Vad blir det kvar av Ka i så fall?
vad är $$\frac{[HA]}[A^-]}$$ ?
Smaragdalena skrev:Johnmaltessons skrev:Smaragdalena skrev:Nästan rätt - natriumjonen skall inte vara med i varken i reaktionsformeln eller uttrycket för syrakonstanten.
Ett sätt att se pKa är som "det pH-värde det är när koncentraionen av syran och dess korresponderande bas är lika". Detta gör att man kan läsa av pKa i en titrerkurva som "det pH-värde det är när man har tillsatt hälften så mycket av basen som vid ekvivalenspunkten". Är detta begripligt, eller behöver du en utförligare förklaring för hur man hittar sitt pKa-värde med hjälp av titrerkurvan?
Då är pka vid 4,5 ml som är ungefär vid 4,3 ph men hur omvandla man det till pKa? det finns ett sätt eller även om det är en konstant för varje syra
Man räknar om mellan pKa och Ka på precis samma sätt som mellan pH och [H3O+].
Jaha ok.
Johnmaltessons skrev:...vad är $$\frac{[HA]}[A^-]}$$ ?
Felskriven LaTeX - fixat nu. Det skall stå .
Smaragdalena skrev:Johnmaltessons skrev:...vad är $$\frac{[HA]}[A^-]}$$ ?
Felskriven lLaTeX - fixat nu. Det skall stå .
Ka blir 1 då
Ka blir 1 då
Nej, det stämmer inte. Visa steg för steg hur du har räknat, så kan vi hitta var det har blivit fel.
Smaragdalena skrev:Ka blir 1 då
Nej, det stämmer inte. Visa steg för steg hur du har räknat, så kan vi hitta var det har blivit fel.
vad menar du? om båda har samma koncentration så betyder att de har samma värde. och om vi dividerar samma värde med sig själv blir svaret 1
Ställ upp HELA uttrycket för Ka, inte bara kvoten mellan syran och basen.
varför blir det [HA]/[A−] om ka = [CH3COONA]/[HA][NAOH]
För tredje gången - det finns inga "NaOH" i jämviktslösningen - natriumhydroxiden är fullständigt hydrolyserad, så det finns hydroxidjoner och natriumjoner. Och du har vänt på definitionen av Ka - det la jag inte märke till tidigare.
så om så är och vilket medför att d v s pKa=pH.
Jaha, ok jag fattar nu! hur göra man om du vill hitta protolysgraden för syran? om vi pratar om ättiksyran så antar jag att protolysgraden är inte så hög p.g.a der är en svag syra. blir inte protolysgraden den mängd av ättiksyra som har protoylserat och blivit H3O+ dvs koncentration av oxiunimjon är protolysgraden?
Johnmaltessons skrev:Jaha, ok jag fattar nu! hur göra man om du vill hitta protolysgraden för syran? om vi pratar om ättiksyran så antar jag att protolysgraden är inte så hög p.g.a der är en svag syra. blir inte protolysgraden den mängd av ättiksyra som har protoylserat och blivit H3O+ dvs koncentration av oxiunimjon är protolysgraden?
Börja med att ta reda på vad som menas med "protolysgraden". Protolysgraden är pH-beoende.
om vi har koncentrationen av syran så kan vi räkna ut protolysgraden genom att dela koncentration av vätejonerna som har protolyserad med koncentration av syra eller? protolysgraden är mängden av syran som har protolyserad och reagerade
Hur definierar du protolysgrad, menar du? Skriv upp det på ett sådant sätt att man kan sätta in siffrorna och räkna ut protolysgraden.
tack för din hjälp!
Har du löst din uppgift?


