Bindingar

 Jag undrar hur jag ska göra med Cl i NH4Cl.
Jag undrar hur jag ska göra med Cl i NH4Cl.
Sen har jag gjort rätt krig de andra bindingarna och dess energi?
Det framgår av uppgiftens formulering att du just har räknat ut H för NH3(g) + HCl(g) => NH4Cl(s). Om man har den sifferuppgiften är den här uppgiften jättelätt.
Ammoniumklorid är ett salt, så det är jonbindning (Coulpmbkrafter) mellan ammoniumjoner och kloridjoner.
Smaragdalena skrev:Ammoniumklorid är ett salt, så det är jonbindning (Coulpmbkrafter) mellan ammoniumjoner och kloridjoner.
Men som du ser så har jag ritat NH4 så hur ska jag rita om klorjoner ska in i bilden?
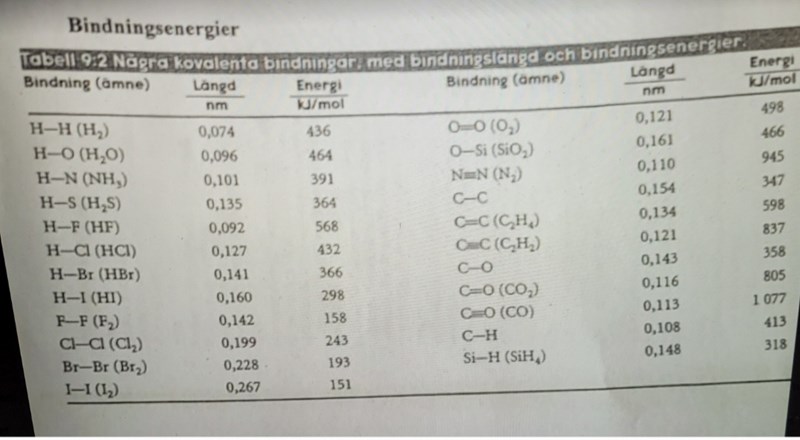
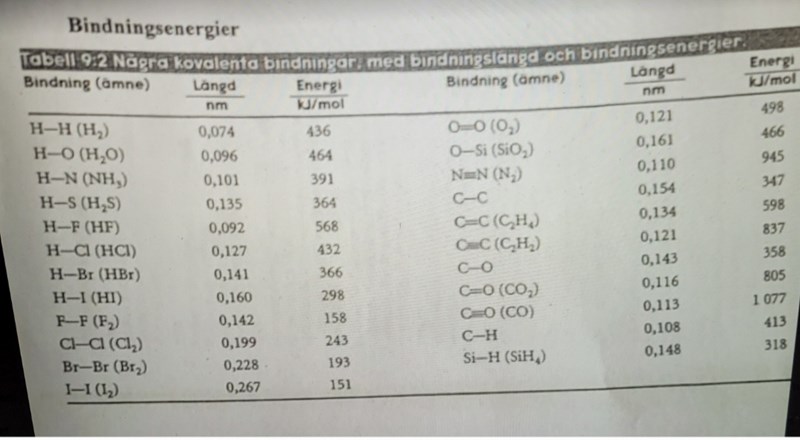
Sen när man tittar på bindingsenergierna (pappret som jag lagt in ovan) så vet jag inte hur energierna blir. Det finns liksom inte nån bindning med NH4Cl. De finns bara separat.
Hur skulle du gjort för att få bindningsenergin för NH4Cl?
offan123 skrev:Hur skulle du gjort för att få bindningsenergin för NH4Cl?
Du behöver veta vilken kristallstruktur ammoniumklorid har, och avståndet mellan jonerna. Då kan du beräkna jonbindningarnas styrka med hjälp av Coulombs lag (men jag skulle tro att det är på universitetsnivå).
Bindningsenergier handlar om kovalenta bindningar, och är alltså inte relevant när det gäller jonbindningar.
Men det är ingenting som behövs för den här uppgiften, om du har svarat på de tidigare deluppgifterna.
 Det enda jag får veta i de tidigare uppgifterna är att delta H=-220 Kj
Det enda jag får veta i de tidigare uppgifterna är att delta H=-220 Kj
Det räcker för att svara på d-frågan. Om reaktionen åt ena hållet är exoterm med ett visst värde på entalpiändringen, så är "baklängesreaktionen" endoterm med ett lika stort värde på entalpiändringen.
på c) blir det 220 Kj men på d) får de -220 kj
Fast om man tänker sig c) så kan man utgå från bilden då allt inte är omvänt, och då så står det Delta H= -220 KJ.
Hänger inte helt med forfarande.
På c kan man se att entalpin för reaktanterna är högre än för produkterna, d v s Hefter - Hföre är negativt (reaktionen är exoterm).


