Brustablett laboration
Hej Pluggakuten!
Jag sitter med en laboration och tror jag har fått lite avvikande resultat. Laborationens syfte är att undersöka hur lång tid det tar att lösa en brustablett och förklara varför. Laborationens "förkunskaper" lyder:
Brustabletter består till stor del av natriumvätekarbonat. När tabletter av det här slaget löser sig i vatten bildas koldioxid. Men om vätskan redan innehåller koldioxid, till exempel kolsyrat vatten, kommer det ta längre tid för tabletten av lösa sig. Ju närmare kemisk jämvikt en reaktion kommer, desto långsammare går den. När tabletten löses upp frigörs karbonat och vätekarbonat. Om dessa redan finns är lösningen redan från start närmare jämvikt jämfört med om brustabletten hade lösts i rent vatten.
Sedan ska brustabletter, t.ex. vitamin C, lösas i vatten, kolsyrat vatten och avslaget kolsyrat vatten. Sen ska man ta tid på hur lång tid upplösningen tar. Vidare ska man testa vatten i olika temperaturer, och att lösa ytterligare en tablett i blandningarna.
Detta tolkar jag som att det kommer ta längst tid för tabletterna att lösa sig i kolsyrat vatten, näst längst i avslaget kolsyrat vatten och snabbast i vanligt vatten, samt att det kommer gå snabbare att lösa den andra tabletten (?).
Mina resultat motsäger dock detta och jag undrar om jag bara tolkat faktan fel eller om jag fått avvikande resultat:
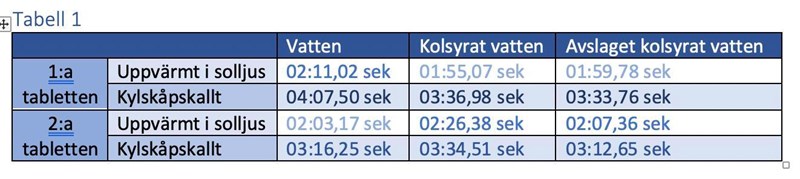
Ett avvikande resultat är fortfarande ett resultat (eller?), så är detta ändå något jag kan använda i laborationen? Eller bör jag göra om den helt och hållet?
Tack på förhand!
Man kan alltid göra ett experiment fler gånger. Egentligen är det bra att säg ta tre mätningar med ljummet vatten. Då får man en insikt om hur stor den "slumpmässiga" variationen är. Kanske skulle visa sig att det kan skilja sig 1min i identiska situationer och då kanske inte variationen mellan okolsyrat och kolsyrat vatten är signifikant.
Finns ju ett så kallat avgränsningsproblem. När är tabletten egentligen upplöst? Kanske säger jag att den är upplöst 30s innan du tycker att den är helt upplöst.
Även kontroll: när du skapat ljummet kolsyrat eller kallt kolsyrat vatten så har väl temperaturäbdringen skett i en sluten behållare?
Som jag ser det är delar av dina tolkningar rätt och andra delar fel så gå igenom dina slutsatser punktvis och motivera dem utifrån din tolkning av begreppen.
Jag tror att... därför att... men i experimentet...
Du verkar ju ha fått helt olika resultat för första och andra tabletten, så du kommer inte att kunna dra någon slutsats. Det bästa vore om du kunde upprepa experimentet fler gånger, kanske uppemot 10 gånger och se ifall det alls finns någon form av skillnad i upplösningstid.
@Teraeagle Om jag tolkat beskrivningen rätt så läggs den andra i efter att den första lösts upp. Så situationen ändras och är inte något underligt att det skiljer sig då första tabletten förändrar vätskan (samt att det kalla ges tid att värmas upp något)
Även kontroll: när du skapat ljummet kolsyrat eller kallt kolsyrat vatten så har väl temperaturäbdringen skett i en sluten behållare?
Ja! Jag köpte 33 cl flaskor som fick stå utomhus i solljuset och i kylskåpet med korken på.
Som jag ser det är delar av dina tolkningar rätt och andra delar fel så gå igenom dina slutsatser punktvis och motivera dem utifrån din tolkning av begreppen.
Har inte hittat mycket information om just denna laborationen i kursboken eller på internet, eller så har jag inte lyckats applicera den kunskap jag inhämtat från kapitlen i boken. Baserat på förkunskaperna i laborationen så är min hypotes nånting sånt här:
- "Men om vätskan redan innehåller koldioxid, till exempel kolsyrat vatten, kommer det ta längre tid för tabletten att lösa sig" – detta tolkar jag som att tabletten kommer lösa sig snabbare i vatten > avslaget kolsyrat vatten > kolsyrat vatten. Tolkar det även som att när den första tabletten löst sig så innehåller lösningen också mer koldioxid då den bildar koldioxid vid upplösning, så tekniskt sett borde det väl ta längre tid för den andra tabletten att lösa sig av det skälet.
- "Om dessa (karbonat och vätekarbonat) redan finns är lösningen redan från start närmare jämvikt jämfört med om brustabletten hade lösts i rent vatten." – jag är lite osäker på hur jag ska tolka detta. Om dessa redan finns är man närmare jämvikt? Då borde det väl av det skälet gå snabbare innan tabletten löst sig? Det står ju att det går långsammare ju närmare jämvikt, men man har ju ändå tagit sig förbi den "snabba starten" (som efterföljer det "långsammare avslutet"), så det borde väl tekniskt sett gå snabbare totalt sett ändå? Om mitt resonemang här är förståeligt...
Och ja @teraeagle och @seriouscephalopod, jag har lagt i tablett nr 2 i samma lösning som den första, enligt instruktionerna i laborationen.
Rent generellt håller jag absolut med om att denna laboration är otillräcklig och borde göras många gånger för att få ett tydligt resultat, och även under mer radikala och kontrollerade förhållanden med temperaturer etc. Dock är ju detta kemi 2 på gymnasienivå, och jag gör det dessutom som en hemmalaboration då jag studerar på distans. Jag satsar på A (vilket jag uppnådde i kemi 1!), och funderar på om jag kan rädda mig själv om jag skriver bra bakgrundsfakta och en diskussion baserat på detta, eller om jag helt enkelt måste göra om laborationen (vilket jag såklart inte har lust med)
Har läst på lite extra om reaktionshastigheter nu (för det är väl det laborationen handlar om egentligen? Inte jämviktslägen och jämviktskonstanter?)
Syfte: Att undersöka hur lång tid det tar att lösa en brustablett och förklara varför.
Om detta är reaktionerna vid upplösningen (korrekt?):
NaHCO3 (aq) ↔ Na+ (aq) + HCO3- (aq)
HCO3- (aq) + H3O+ (aq) ↔ H2CO3 (aq) + H2O (l)
HCO3- (aq) + H2O (l) ↔ CO32- (aq) + H3O+ (aq)
H2CO3 (aq) ↔ CO2 (aq) + H2O (l)
Har jag då förstått detta rätt:
- Hög halt koldioxid gynnar reaktioner där koldioxid är en av reaktanterna, och missgynnar reaktioner där koldioxid är en produkt
- Låg eller ingen halt koldioxid gynnar reaktioner där koldioxid är en produkt, och missgynnar reaktioner där koldioxid är en av reaktanterna
- Hög halt vätekarbonat gynnar reaktioner där vätekarbonat är en av reaktanterna, och missgynnar reaktioner där vätekarbonat är en produkt
- Låg eller ingen halt vätekarbonat gynnar reaktioner där vätekarbonat är en produkt, och missgynnar reaktioner där vätekarbonat är en av reaktanterna
Med produkt menar jag önskad produkt. Typ i detta fall "önskar" man ju att natriumvätekarbonatet ska lösas upp till koldioxid. Med gynnar menar jag att det påskyndar reaktionen, och med missgynnar menar jag att det inte gör något för att påskynda.
- Endoterma reaktioner (typ alla upplösningsreaktioner?) gynnas av hög temperatur, och missgynnas av låg temperatur
- Exoterma reaktioner (typ ingen upplösningsreaktion?) gynnas av låg temperatur, och missgynnas av hög temperatur
Baserat på allt detta borde alltså alla upplösande reaktioner i processen gå snabbare i det varmare vattnet och långsammare i det kalla vattnet, samt att de reaktioner där produkterna redan finns i lösningen kommer gå långsammare än om de inte fanns, och de reaktioner där reaktanterna redan finns kommer gå snabbare än om de inte fanns?
Blev mycket skriverier här nu från min sida men jag hoppas ni orkar med att läsa ändå. Tycker den här laborationen känns svår och har suttit fast med den ett bra tag nu. Hoppas det lossnar snart!!



