Buffertlösning
Hej!
Jag skulle behöva lite hjälp med en del av följande fråga då min lösning inte riktigt stämmer med facit.
"In a biological experiment it was crucial to maintain pH at 6.9. To achieve this you need to prepare 0.50 dm3 of a 20 mM phosphate buffer. Calculate and describe the procedure using only 1.0 M NaOH, NaH2PO4(s), 1.0 M HCl and water."
Koncentrationerna jag fått stämmer överens med facit men sen har jag löst det på ett annat sätt än facit. 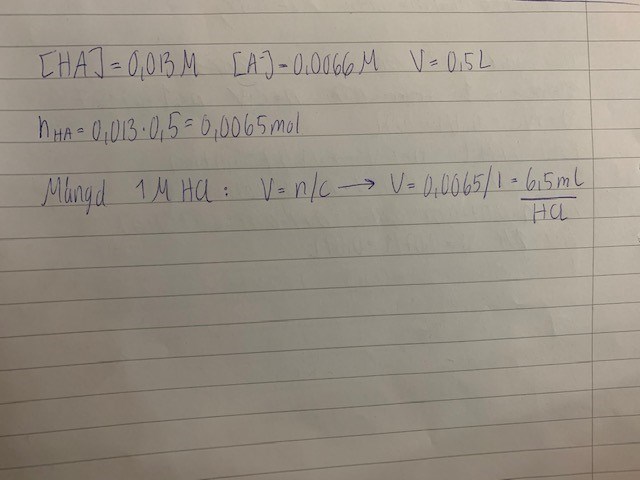 Jag har alltså valt att tillsätta HCL för att få en buffert enligt beräkningen ovan men på facit har de tillsatt 3,3 ml NaOH. Jag förstår hur det har räknat ut mängden NaOH. Men vad är förklaringen till att jag inte kan välja HCL till min buffert?
Jag har alltså valt att tillsätta HCL för att få en buffert enligt beräkningen ovan men på facit har de tillsatt 3,3 ml NaOH. Jag förstår hur det har räknat ut mängden NaOH. Men vad är förklaringen till att jag inte kan välja HCL till min buffert?
Tack på förhand!
När du löser upp natriumdivätefosfat i vatten får du en lösning som är surare än pH 6,9. Då måste du sätta till NaOH för att få rätt pH.
Tack för snabbt svar. Hur vet man att man får en surare lösning när man löser upp natriumdivätefosfat i vatten? Kan du förklara lite mer hur man ska tänka där?
Tack på förhand!
Man tittar på pKa-värdet och räknar lite. Vilket pKa-värde har jonen (syran) H2PO4-?
Vad är det man behöver räkna ut? Jag använde pka för H2P04- som var 7,21. Låg närmast pH 6,9.
Det finns lite olika sätt att räkna på de här flerprotoniga syrorna. Det är svårt att hjälpa dig på exakt samma sätt som din bok/lärare eftersom jag inte vet vilken variant ni använder. Men ett ganska enkelt sätt att tänka på det är så här:
H2PO4- är både en syra och en bas. Vilken rektion kommer att dominera när man löser upp den i vatten?
pKa är 7,2
pKb är 11,9
Alltså är den starkare som syra än som bas och syrareaktionen kommer att dominera. Då kan man räkna som om den var en enprotonig syra med koncentrationen 20 mM och beräkna ungefär vilket pH man kommer att få. Det är en förenkling men den ger ett tillräckligt bra svar. Vi har jämvikten:
H2PO4- + H2O <--> HPO42- + H3O+
Sedan använder du pKa =7,2 och en vanlig jämviktsuppställning för att beräkna pH. Du bör få pH ≈ 3 (men det är sent och jag har inte dubbelkollat min beräkning). Och då vet du att du måste tillsätta NaOH för att få pH 6,9.
Därefter kan du använda buffertformeln.


