FAQ: Vad behöver jag kunna inom ämnet kemi?
Den här tråden är tänkt att ge svar till några av de vanligaste frågorna i kemiforumet. Utgå ifrån att inläggen tar upp saker du förväntas lära dig i gymnasiets kemikurser. Om en fråga hör till universitetsnivå bör det framgå i inlägget, men ge gärna en djupare förklaring av svaret i slutet av inlägget som den intresserade kan läsa för att få större förståelse.
Regler för tråden:
- Ett inlägg ska innehålla en fråga med tillhörande svar.
- Undvik att posta inlägg som tar upp frågor redan behandlade i andra inlägg i tråden. Kontakta en moderator om du vill komplettera eller ändra ett trådinlägg.
- Posta inte frågor där du inte kan svaret. Starta istället en ny tråd i kemiforumet.
Inlägg som inte följer trådens regler kan komma att raderas.
Innehållsförteckning:
1. Vilka syror och baser behöver jag lära mig?
2. Hur tar jag reda på jonens laddning och vilka joner bör jag lära mig utantill?
3. Vilka kolväten och funktionella grupper borde jag känna till?
4. Vad betyder alla siffror i en kemisk formel?
5. Hur avgör jag vilket ämne som har högst kokpunkt?
6. Varför kan vissa metalljoner ha sura egenskaper?
7. Hur balanserar jag en redoxreaktion?
8. Varför bildar större molekyler starkare van der Waals-bindningar?
9. Vad är skillnaden mellan en sur lösning och en syra, samt en basisk lösning och en bas?
10. Är en proton samma sak som en vätejon?
11. Vilka av glykolysen, citronsyracykeln och elektrontransportkedjan är beroende av syrgas?
12. Vad betyder multiplikationstecknet i vissa kemiska formler?
13. Hur vet jag om en reaktion kommer att ske spontant?
14. Varför är vissa salter svårlösliga medan andra är lättlösliga och kan man avgöra det utifrån deras kemiska formler?
16. Jag ska skriva en laborationsrapport men vet inte vad man bör ta upp i diskussionen. Hur skriver jag en bra rapport?
17. Jag har inte förstått molbegreppet. Vad är det egentligen man mäter?
20. Hur använder jag bindningsenergier för att uppskatta hur mycket energi som frigörs i en reaktion?
21. Varför behövs en kopparspik ifall det är vätejoner som reduceras i ett citronbatteri?
22. Hur fungerar atomorbitaler och hur skiljer de sig från modellen med elektronskal?
Vilka syror och baser behöver jag lära mig?
Vissa ämnen har namn som inte beskriver deras kemiska uppbyggnad, vilket gör att man behöver lära sig dem och deras formler utantill. I andra fall är det inte helt självklart att ett ämne har syrabasegenskaper. Nedanstående lista kan ses som en gloslista med syror och baser du förutsätts känna till på gymnasienivå.
Starka syror:
- Svavelsyra -
- Salpetersyra -
- Saltsyra (egentligen väteklorid) -
Svaga syror:
- Kolsyra -
- Fosforsyra -
- Ättiksyra - men oftast förkortad
- Ammoniumjonen -
- Aluminiumjonen (se förklaring i det här inlägget) -
- Järn(III)-jonen (se förklaring i det här inlägget) -
Starka baser:
- Natriumhydroxid -
- Kaliumhydroxid -
- Kalciumhydroxid -
Svaga baser:
- Ammoniak -
- Acetatjonen - men oftast förkortad
- Karbonatjonen -
Hur tar jag reda på jonens laddning och vilka joner bör jag lära mig utantill?
Det är relativt enkelt att ta reda på laddningen hos jonerna till ämnen i grupperna 1, 2, 14, 15, 16 och 17 i periodiska systemet. Samtliga av dessa ämnen strävar efter att uppnå ädelgasstruktur, vilket betyder att de omges av åtta valenselektroner. Genom att lokalisera ett ämne i periodiska systemet kan man ta reda på vilken grupp ämnet hör till. Den sista siffran i gruppnumret anger hur många valenselektroner dess atomer har i neutralt tillstånd. Atomerna kommer då att ta upp eller avge valenselektroner tills de omges av totalt åtta stycken.
Klor har den kemiska beteckningen Cl och befinner sig i grupp 17 , vilket betyder att dess atomer har sju valenselektroner. De kommer då att ta upp en elektron var och få en extra negativ laddning, vilket betyder att dess joner skrivs .
Magnesium har den kemiska beteckningen Mg och befinner sig i grupp 2 och omges därför av två valenselektroner. Genom att avge dessa två negativt laddade elektroner fås ett överskott av två positiva laddningar, vilket innebär att jonerna skrivs .
Ämnen som befinner sig i övriga grupper är uteslutande metaller, främst s.k. övergångsmetaller. Det är notoriskt svårt att förutspå vilka laddningar deras joner har och det finns oftast flera olika möjligheter. Därför bör man lära sig laddningarna hos de vanligaste jonerna utantill. De du bör lära dig i första hand är:
- Zinkjoner -
- Kopparjoner -
- Järnjoner - eller
- Blyjoner -
- Silverjoner -
- Aluminiumjoner -
Några av dessa joner förekommer i andra varianter, exempelvis i fallet koppar. Dessa är dock relativt ovanliga i gymnasiekemin.
Förutom de enatomiga jonerna bör du lära dig namn, formel och laddning till följande s.k. sammansatta joner:
- Sulfatjoner -
- Vätesulfatjoner -
- Nitratjoner -
- Karbonatjoner -
- Vätekarbonatjoner -
- Fosfatjoner -
- Vätefosfatjoner -
- Divätefosfatjoner -
- Hydroxidjoner -
- Oxoniumjoner -
- Ammoniumjoner -
- Permanganatjoner -
- Cyanidjoner -
Vilka kolväten och funktionella grupper borde jag känna till?
Du bör först och främst lära dig de tio första kolvätena i alkanserien. En alkan kan skrivas på den generella formen . De tio första är:
- Metan -
- Etan -
- Propan -
- Butan -
- Pentan -
- Hexan -
- Heptan -
- Oktan -
- Nonan -
- Dekan -
Förutom kolvätena i alkanserien är det bra att känna till det ringformade ämnet bensen och dess formel .
De viktigaste funktionella grupperna att lära sig är följande (R betecknar resten av molekylen):
- Hydroxyl (eller hydroxi) -
- Amin -
- Karboxyl -
- Karbonyl -
Vad betyder alla siffror i en kemisk formel?
Det finns två typer av siffror som används i kemiska formler:
- Nedsänkt efter namnet på ett atomslag. Ett exempel är vattenmolekylen . Här säger tvåan att det finns två väteatomer i en vattenmolekyl. Om man har 20 vattenmolekyler finns det alltså 40 väteatomer. Om man har 3 mol vatten finns det 6 mol väte.
- Till vänster om föreningens namn. Detta förekommer bara i reaktionsformler och anger hur många molekyler eller enheter av ämnet som reagerar. Ett exempel är . Formeln säger att två vätemolekyler reagerar med en syremolekyl och bildar två vattenmolekyler. Man kan också se det som att två mol vätgas reagerar med en mol syrgas och bildar två mol vatten. Tvåan före respektive säger alltså ingenting om hur många atomer av respektive atomslag som finns i en förening, utan då ska siffran vara nedsänkt enligt föregående punkt.
Ett vanligt misstag är felaktig beräkning av molmassan hos ett ämne. Molmassan anger hur mycket 1 mol, vilket motsvarar stycken enheter (t.ex. molekyler) av ämnet väger. Här bryr vi oss alltså bara om hur många atomer som ingår i varje molekyl, inte hur många molekyler som reagerar i en reaktion. I exemplet ovan ska vi alltså beräkna molmassan för och inte .
Hur avgör jag vilket ämne som har högst kokpunkt?
Kokpunkten är en direkt konsekvens av bindningsstyrkan mellan molekylerna, atomerna eller jonerna som ämnet består av. Bindningstyperna vi är intresserade av (när det gäller molekylära ämnen) efter fallande styrka är:
- Vätebindning
- Dipol-dipolbindning
- Svag van der Waals-bindning ("dispersionskrafter")
Ett ämne med vätebindning kan alltså förväntas ha högst kokpunkt, eftersom bindningarna då är ganska starka mellan ämnets molekyler. De måste röra sig väldigt fort för att kunna frigöra sig från andra molekylers grepp och övergå i gasfas. Ett annat sätt att se på det är att kokpunkten måste vara väldigt hög för ämnen med starka bindningar mellan molekylerna eftersom temperaturen anger hur snabbt de rör sig. Vätebindningar kan bara uppstå om man har bindningar mellan väte och fluor, syre eller kväve inom molekylerna. Detta kallas för FON-regeln som du kan läsa mer om här. Exempel på ämnen med vätebindning och hög kokpunkt är vatten (100 °C), metanol (65 °C), vätefluorid (20 °C) och ammoniak (-33 °C).
Dipol-dipolbindning kan uppstå mellan molekyler som innehåller bindningar mellan två atomslag med olika elektronegativitet. Om en kemisk förening innehåller kol eller väte tillsammans med elektronegativa ämnen som klor och svavel kan man alltså förvänta sig att det finns dipol-dipolbindning mellan molekylerna. Dessa ämnen har ganska höga kokpunkter, men inte lika höga som hos ämnen med betydligt starkare vätebindningar. Några exempel på föreningar vars molekyler binder till varandra med dipol-dipolbindningar är klormetan (-24 °C), svavelväte (-60 °C) och vätebromid (-66 °C).
Van der Waals-bindningar är normalt väldigt svaga och bör ge ämnen med denna bindningstyp låga kokpunkter. Det är dock inte alltid fallet, för van der Waals-bindningars styrka beror på molekylvikt (egentligen deras area, men ökad vikt brukar ge ökad area). Om man har tunga kolväten med långa kolkedjor kan man alltså förväntas sig att de har höga kokpunkter. Om molekylerna är tillräckligt tunga kan kokpunkterna även vara högre än för ämnen med vätebindning. Denna effekt gäller även för ämnen med dipol-dipolbindning, eftersom van der Waals-bindning är något som uppstår mellan alla typer av molekyler. Exempel på lätta molekyler med van der Waals-bindning är metan (-162 °C), syrgas (-183 °C) och vätgas (-253 °C). Exempel på tunga molekyler med van der Waals-bindning är jod (184 °C), oktan (126 °C) och radon (-62 °C).
Exempel: Rangordna ämnena , , och efter fallande kokpunkt.
Det första vi ska göra är alltså att ta reda på vilken bindningstyp som finns i respektive fall. innehåller två ämnen med olika elektronegativitet, så där bör vi ha dipol-dipolbindning. innehåller en hydroxigrupp med bindning mellan väte och syre, vilket ger vätebindning och en hög kokpunkt. är ett typexempel på en förening med svagare van der Waals-bindingar. är lite klurig, eftersom vi har två ämnen med väldigt olika elektronegativitet som då borde ge dipol-dipolbindning. Här gäller det dock att notera att molekylen är symmetrisk, vilket inte ger något dipolmoment. Molekylen är alltså ingen dipol och vi kan inte skapa dipol-dipolbindningar utan får nöja oss med svag van der Waals-bindning. Vi vet också att är en tyngre molekyl än och kommer därför att ha starkare bindningar.
Om vi rangordnar ämnena efter fallande bindningsstyrka borde vi alltså även ha rangordnat dem efter fallande kokpunkt:
Slår vi upp tabellvärden för kokpunkterna får vi fram 78 °C, -66 °C, -128 °C och -253 °C, vilket stämmer med vår rangordning efter bindningsstyrka.
Varför kan vissa metalljoner ha sura egenskaper?
Ibland dyker det upp "elaka" uppgifter där man ska ange ifall ett ämne ger sur eller basisk reaktion när det löses i vatten. är ett salt som ger neutral reaktion, medan ger sur reaktion. Det finns inga vätejoner som kan avges, så varför får man en sur reaktion i det andra fallet?
Förklaringen kallas för hydrolys och är något som inträffar när man har joner med hög laddning och liten jonradie i vattenlösning. I praktiken ska man hålla utkik efter salter innehållande metalljoner med laddningen +3 eller högre. De två viktigaste exemplen är och , vars jonradier är 53 pm respektive 69 pm. Jämför dessa värden med som har radien 102 pm och tre gånger lägre laddning. Om man räknar ut jonernas "laddningsdensiteter", dvs deras laddning delat med volym så kommer de att vara betydligt högre för och jämfört med . Det ger ett mycket starkt elektriskt fält runt jonerna som attraherar fria elektronpar i omgivande vattenmolekyler. Attraktionen är så pass stark att det uppstår kovalenta bindningar mellan vattenmolekyler och metalljoner. Eftersom syre nu deltar i en bindning för mycket jämfört med vad som krävs för att uppnå ädelgasstruktur, kommer en av bindningarna till väte att offras. Vätejoner frigörs och gör lösningen sur.
Hur balanserar jag en redoxreaktion?
Först och främst: en redoxreaktion är en reaktion där något eller några atomslag ändrar oxidationstal. Man måste alltså börja med att sätta ut oxidationstalen för alla atomer bland reaktanter och produkter. Det finns sedan två metoder för att balansera reaktionen: oxidationstalsmetoden och delförloppsmetoden.
Oxidationstalsmetoden
Låt oss börja med att balansera reaktionen
som vi har fått angivet sker i sur vattenlösning. Det betyder att vi är fria att lägga till vätejoner och vattenmolekyler hur vi vill i formeln för att balansera den. Vi vet att den är balanserad när...
- Det tas upp och avges lika många elektroner.
- Det finns lika många atomer av varje atomslag på båda sidor om reaktionspilen.
- Den totala laddningen är lika stor på båda sidor om reaktionspilen.
När vi har satt ut oxidationstalen ser vi att järn går från +II till +III, vilket betyder att varje järnjon avger en elektron. Vi ser även att mangan går från +VII till +II, vilket betyder att varje manganatom tar upp fem elektroner. Nyckeln här är att det måste tas upp och avges lika många elektroner, eftersom de inte bara kan försvinna i tomma intet. Med det villkoret måste vi ta fem järnjoner för varje permanganatjon, eftersom vi då både tar upp och avger fem elektroner.
Nu är elektronövergångarna balanserade, men vi har fortfarande mer syre i vänsterledet. Som tidigare nämnt är vi fria att lägga till vatten och vätejoner, så vi kan lägga till fyra vattenmolekyler i högerledet far att balansera upp syret.
Nu uppstår nästa problem, nämligen att det finns för mycket väte i högerledet. Vi lägger till åtta vätejoner i vänsterledet för att kompensera för detta.
Nu är alla atomslag balanserade, men vi måste också kontrollera att den totala laddningen är lika på båda sidor. Eftersom vi har nettoladdningen +17 på båda sidor vet vi att den är balanserad.
Delförloppsmetoden
Den här metoden kallas ibland för halvcellsmetoden och vi kan ta reaktionen
som exempel för att visa hur den fungerar. Strategin är att dela upp reaktionen i en oxidation och en reduktion i två delförlopp/halvceller och sedan lägga ihop dem på slutet. Börja med att sätta ut oxidationstalen. Vi ser då att natrium oxideras och kan sammanfatta oxidationen som
där betecknar en elektron. I vattnets fall kan vi se att väte reduceras från +I till 0, vilket innebär att varje väteatom tar upp varsin elektron. Då vi har två väteatomer i en vattenmolekyl måste varje vattenmolekyl ta upp två elektroner:
För att balansera syre kan vi inte lägga till vatten, så det näst bästa alternativet är att det bildas hydroxidjoner.
Nu är inte väte längre balanserat, så vi måste ta ytterligare en vattenmolekyl för att återbalansera väte. Eftersom vi då återigen har för lite syre lägger vi till en till hydroxidjon för att balansera delförloppet:
Nu vet vi att delförloppen som ska läggas ihop är:
Eftersom det första delförloppet avger hälften så många elektroner som det andra delförloppet tar upp, måste vi multiplicera alla koefficienter med två i det första delförloppet innan de läggs ihop.
Nu kan vi förkorta bort elektronerna från formeln för att få fram den slutgiltiga, balanserade formeln:
Varför bildar större molekyler starkare van der Waals-bindningar?
Det här är en statistisk konsekvens. Större molekyler innehåller fler elektroner och det är på så vis mer sannolikt att några av elektronerna tillfälligt avviker från sina ordnade platser än i en mindre molekyl med färre elektroner. Det är dessa avvikelser som skapar laddningsförskjutningar och tillfälliga poler som fortplantar sig mellan molekylerna och verkar attraherande.
Vad är skillnaden mellan en sur lösning och en syra, samt en basisk lösning och en bas?
Med "sur lösning" menas en vattenlösning av något ämne där pH-värdet är lägre än 7. Eftersom pH-värdet beskriver koncentrationen av vätejoner, eller egentligen oxoniumjoner i lösningen, innebär det att en sur lösning har en vätejonkoncentration högre än enligt sambandet .
En basisk lösning har istället ett pH-värde över 7. Det betyder att vätejonkoncentrationen är lägre än . Man kan också se det som att hydroxidjonkoncentrationen är högre än . Dessa beskrivningar säger samma sak.
En syra och bas kan definieras på minst tre olika sätt:
- Arrhenius definition: Det här är den äldsta och minst använda av de tre definitionerna. Här ses en syra som ett ämne som delas upp i vätejoner och något annat vid upplösning i vatten. Exempel på Arrhenius-syror är och . Baser är ämnen som delas upp i hydroxidjoner och något annat vid upplösning i vatten. Exempel på Arrhenius-baser är och .
- Brønsteds definition: Det här är den vanligaste definitionen inom gymnasiekemin. Den beskriver en syra på samma sätt som Arrhenius definition, d.v.s. att den ska ha möjlighet att ge ifrån sig vätejoner. En bas är däremot något som kan ta upp vätejoner. Exempel på Brønsted-baser är , och (acetatjon).
- Lewis definition: Den mest generella definitionen som även inkluderar alla av Brønsteds syror och baser. En syra är ett ämne med förmåga att motta ett elektronpar från en bas, vilken i sin tur beskrivs som en elektronpardonator. Definitionen är ganska ovanlig inom gymnasiekemin, men är väldigt användbar inom vissa områden. Exempel på Lewis-syror är jonerna till övergångsmetallerna, medan halogenernas joner är exempel på Lewis-baser. Själva vätejonen i sig är ett exempel på en Lewis-syra, vilket skulle vara rätt motsägelsefullt enligt Brønsteds syradefinition. är ett exempel på en syrabasreaktion enligt Lewis, även om det till en början kan verka knepigt.
Är en proton samma sak som en vätejon?
Begreppen används ofta synonymt med varandra, men ska man vara petig beskriver de inte riktigt samma sak. Det är mer korrekt att säga att en syra avger en vätejon, jämfört med att säga att den avger en proton. Trots det är "protonövergång" allmänt vedertaget och har till och med präglat namnet på reaktionen - protolys.
Varför är det då inte riktigt samma sak? Väte består av en isotopblandning motsvarande 99,9885 % väte-1, 0,0115 % väte-2 och spårmängder av radioaktivt väte-3. Man kan alltså ha en vätejon som hör till isotopen väte-2 eller väte-3, men då är det inte längre en proton eftersom det även finns en respektive två neutroner i atomkärnorna. Trots att mängderna kan verka små, kommer man ha cirka vätejoner av isotopen väte-2 i ett ynka gram.
Vilka av glykolysen, citronsyracykeln och elektrontransportkedjan är beroende av syrgas?
Om du kollar på de olika reaktionsstegen för de tre processerna kommer du märka att syrgas bara finns som reaktant i elektrontransportkedjan. Det är alltså den enda process som är direkt beroende av syrgas för att fungera. De övriga processerna kräver däremot något annat, nämligen elektronbärare som NAD+ och FAD. Dessa produceras inte i obegränsade mängder i cellerna, utan när de har reducerats till NADH och FADH2 måste de oxideras tillbaka till NAD+ och FAD. Denna oxidation sker i elektrontransportkedjan, vilken ju var beroende av syrgas. Om det inte finns någon syrgas kommer elektrontransportkedjan inte att fungera, vilket leder till att NAD+ och FAD tar slut. Det gör att citronsyracykeln blir indirekt beroende av syrgas. I glykolysens fall kan NAD+ återbildas genom att NADH reagerar med pyruvatjoner, vilket är slutprodukten i glykolysen. Detta kallas för fermentering (jäsning) och vissa organismer som jästsvampar bildar etanol av pyruvatjonerna, medan andra bildar mjölksyra (laktatjoner) eller andra produkter. Glykolysen är alltså inte beroende av syrgas för att kunna fungera.
Vad betyder multiplikationstecknet i vissa kemiska formler?
Först och främst är det inte ett multiplikationstecken, utan ett sätt att beskriva kristallstrukturen hos ämnet. Det vanligaste exemplet är , vilket anger att det finns vattenmolekyler inlåsta i kristallstrukturen hos . När saltet en gång var i vattenlösning, blev några vattenmolekyler kvar runt jonerna efter indunstning då de attraherar varandra elektrostatiskt eller är sammanbundna till komplexföreningar. Om man vill beräkna molmassan för , ska man summera molmassan hos samt fem molmassor av .
Skrivsättet är väldigt vanligt inom vissa områden som metallurgi, där det kan beskriva uppbyggnaden hos vissa föreningar på ett tydligare sätt. kan exempelvis skrivas som , vilket betyder att föreningen består av tre delar och två delar .
Hur vet jag om en reaktion kommer att ske spontant?
Med "spontan" menas att reaktionen kommer att ske om reaktanterna blandas med varandra utan att man gör något extra, men det säger ingenting om hur snabb reaktionen är. Cellulosamolekylerna i ett träbord reagerar ständigt med luftens syre, men det sker så oerhört långsamt att man inte märker det. Annars skulle i princip varenda organisk förening på jorden brinna upp på nolltid, eftersom förbränning är en spontan process även vid rumstemperatur.
En reaktion är spontan om den leder till en sänkning av Gibbs fria energi, , vilket beräknas utifrån ändringen i entalpi, , ändringen i entropi, , samt temperaturen mätt i Kelvin enligt:
Utifrån formeln kan vi dra följande slutsatser:
- En reaktion som leder till höjning av entalpin och sänkning av entropin är aldrig spontan, eftersom , och medför att .
- En reaktion som leder till sänkning av entalpin och höjning av entropin är alltid spontan, eftersom , och medför att .
- Övriga reaktioner är ibland spontana och ibland icke-spontana, beroende på hur mycket respektive parameter ändras och hur hög temperaturen är.
Det är relativt lätt att avgöra ifall entalpin minskar (exoterm reaktion) eller ökar (endoterm reaktion), eftersom temperaturen ökar om entalpin minskar medan temperaturen minskar om entalpin ökar. Om man inte har kännedom om sådant kan man beräkna entalpiändringen utifrån tabellvärden eller genom att studera vilka bindningar som bryts och bildas.
För att avgöra ifall entropin ökar kan man återigen utnyttja listade tabellvärden, men följande två regler kan vara bra att lära sig:
- Entropin brukar öka om det finns fler partiklar på produktsidan jämfört med reaktantsidan.
- Om det bildas gas från icke-gasformiga ämnen brukar entropin också öka.
Med "ökning av entropi" menar vi här i systemet vi kollar på, d.v.s. en vätska i en bägare eller liknande. Hela universums entropi måste alltid öka vid en spontan process, något som kallas för termodynamikens andra huvudsats.
Varför är vissa salter svårlösliga medan andra är lättlösliga och kan man avgöra det utifrån deras kemiska formler?
Till att börja med borde du läsa igenom det föregående inlägget om spontana reaktioner och processer. Ett salt kommer att lösas upp i vatten tills dess att Gibbs fria energi inte längre minskar. Då säger man att systemet har nått kemisk jämvikt och saltet kristalliseras ut ur lösningen lika snabbt som det löses upp. Alltså kommer man inte längre att lösa upp mer salt totalt sett. Det finns några viktiga minnesregler som du borde (läs: måste) lära dig:
- Nitrater är lättlösliga.
- Alkalimetallernas salter är lättlösliga.
- Salter med ammoniumjoner är lättlösliga.
- Klorider och sulfater är oftast lättlösliga, med de viktiga undantagen , , och . Ytterligare undantag finns.
- Karbonater, fosfater och hydroxider är oftast svårlösliga, såvida de inte kombineras med ammoniumjoner eller jonerna till alkalimetaller.
Med ovanstående regler kan du snabbt få ett hum om ifall ett salt kommer vara lättlösligt eller inte.
Om du vill ha ytterligare ett verktyg för att kunna avgöra ifall ett salt är lätt- eller svårlösligt kan du titta på följande lista:
- Salter där jonerna har höga och allra helst lika höga laddningar är oftast svårlösliga. Ett exempel är som bildas av och .
- Salter där jonerna har korta eller likvärdiga jonradier är oftast svårlösliga. Exempel är som bildas av små aluminiumjoner och oxidjoner. En tabell med radier hos enatomiga joner hittar du här.
- Om ett salt består av en negativ jon med lång jonradie och en högladdad positiv jon med kort jonradie tenderar det också att ge låg löslighet. Anledningen är att de positiva jonerna med lätthet kan polarisera de negativa jonerna och göra att några elektroner delas. Då uppstår en bindning med stora kovalenta inslag istället för ren jonbindning. Sådana föreningar är egentligen inte salter, utan en blandning av salt och nätverksmolekyl som helt enkelt är för stor för att kunna lösas upp. Metallsulfider som kopparsulfid och zinksulfid är typiska exempel.
Det som i många fall avgör om ett salt är lättlösligt är ifall det frigörs mer energi när jonerna binder till vattenmolekyler jämfört med vad det kostar att separera jonerna från varandra i saltkristallerna. Enligt Coulombs lag kommer det vara svårare att separera joner med höga laddningar som ligger nära varandra, vilket förklarar tidigare nämnda tumregler. Däremot frigörs det ofta mer energi när dessa joner binder till vattenmolekyler, så det är inte helt enkelt att avgöra hur stor entalpiändringen blir vid upplösning utan att använda sig av tabellvärdesberäkningar. Det finns dessutom salter som har en endoterm upplösning, vilket innebär att entropin också har betydelse för hur lättlösligt ett salt är. Du kan läsa mer om det i föregående inlägg.
Vad heter utrustningen?

- Pipettfyllare (se även Peléusboll)
- E-kolv, förkortning av Erlenmeyerkolv
- Provrör
- Urglas
- Mätglas eller mätcylinder
- Bägare
- Liebig-kylare
- Rundkolv
- Byrett
- Vollpipett
- Mätpipett
- Flaskborste
- Pipetter
- Spatel
- Gummiproppar
- Trådnät
- Provrörshållare
- Sprutflaska
- Degel
- Degeltång
- Mortel med pistill
- Tratt
- Kristallisationsskål
- Stativ
- Stativmuff
- Triangel
- Bunsenbrännare
- Mätkolv
Jag ska skriva en laborationsrapport men vet inte vad man bör ta upp i diskussionen. Hur skriver jag en bra rapport?
Laborationsrapporter kan vara uppbyggda på olika sätt, men följande är en bra utgångspunkt:
- Sammanfattning – Här ska du kortfattat sammanfatta hela rapporten och helst ta upp delar från varje kapitel. Skriv avsnittet sist, när du vet vad som står under alla kapitel i rapporten och vad du har kommit fram till. Ta inte upp alltför många detaljer, utan sikta på att hålla avsnittet under en halv A4-sida. Sammanfattningen ska även sälja in läsaren att fortsätta bläddra i rapporten, men får samtidigt inte försköna den. Om allting gick fel ska du inte låta det kleta ner hela sammanfattningen, för varför ska då någon ödsla tid på att läsa resten av rapporten?
- Innehållsförteckning
- Inledning – Här tar du upp vad laborationen gick ut på, d.v.s. dess syfte. Ibland är introduktionen uppdelad i separata delar som "Syfte" och "Teori". I den här delen ska du ta upp saker som behövs för att man ska kunna förstå innehållet i rapporten. Kom ihåg att källhänvisa! Om du ska bestämma värdet på någon konstant är det rimligt att ta upp vad konstantens värde brukar vara.
- Metod – Vad gjordes under och efter laborationen? Beskriv utrustningen som har använts, men utelämna onödiga saker som penna och sudd. Metoden ska vara skriven så att en person som läser samma kurs som du kan upprepa laborationen utifrån det som står skrivet.
- Resultat – Här presenterar du helt enkelt vad resultatet blev, men utan att blanda in några tolkningar eller åsikter. Presentera resultatet i tabeller och figurer för att göra det mer lättöverskådligt. Utelämna däremot alltför detaljerade mätvärden och saker som inte behövs för att förstå rapportens innehåll. Stoppa dessa i en bilaga istället.
- Diskussion – Upplevs oftast som den svåraste delen, kanske eftersom ordet "diskussion" inte riktigt avslöjar vad kapitlet handlar om på samma sätt som "metod" och "resultat" gör. Det här är även den enskilt viktigaste delen av rapporten om du vill nå ett högre betyg, eftersom den visar ifall du har förstått vad laborationen gick ut på samt den underliggande teorin. I diskussionen ska du knyta ihop de föregående delarna, samt komma fram till en slutsats. Är resultatet rimligt? Hur säker kan man vara på att resultatet är rättvisande? Stämmer resultatet med det du skrev i inledningen? Det är även viktigt att kritisera den valda metoden och resonera kring ifall en annan metod hade gett ett säkrare resultat. Hade det varit bättre att mäta saltsyrans koncentration med titrering jämfört med en pH-elektrod? I diskussionen ska du även presentera felkällor, d.v.s. vilka saker som kan ha gått fel och därigenom påverkat resultatet. Motivera varför felkällan du tar upp är viktig och hur den kan ha påverkat resultatet. Undvik dock att reducera hela diskussionen till en punktlista med felkällor - det är inte att diskutera! Avsluta diskussionen genom att formulera en slutsats i stil med "Den här laborationen visar att...". I vissa fall är det bättre att bryta ut slutsatserna helt och hållet och lägga dem i ett eget kapitel.
- Referenser – Här presenterar du alla källor som används i arbetet enligt något referenssystem som Harvard eller Oxford. Om du vill fördjupa dig i ämnet är Röda korsets APA-referensguide att rekommendera. Den hittar du här.
Något som gäller för hela rapporten är att du ska skriva på ett korrekt språk. Det innebär att du bör använda ett rättstavningsprogram och utelämna ord som jag, vi och de. Skriv allting i dåtid förutom när det handlar om hänvisningar i rapporten, t.ex. "blandningen hettades upp" och "tabell 2 visar att". Du bör även kalla saker vid deras rätta namn och använda korrekt terminologi, exempelvis byrett istället för "långt glasrör".
Jag har inte förstått molbegreppet. Vad är det egentligen man mäter?
Mol är SI-enheten för substansmängd och det man mäter är hur många partiklar som finns i det man studerar. Partiklarna i fråga är oftast atomer, joner eller molekyler. En mol motsvarar ungefär partiklar, en konstant som kallas för Avogadros tal. Om vi säger att det finns 1 mol vatten, menar vi egentligen att det finns vattenmolekyler. Eftersom det är väldigt opraktiskt att räkna med så stora tal, är det mer bekvämt att kalla antalet för "1 mol" istället.
Hur många molekyler ATP bildas det från en glukosmolekyl i energimetabolismen? Är det 38, 36, 32 eller 30?
Om man får siffran 36 eller 38 beror på vad som händer med det NADH som bildas i glykolysen. Glykolysen äger ju rum i cytosolen, så de NADH-molekylerna kan inte användas i andningskedjan rakt av.
Det finns två olika vägar som cellen använder. Båda bygger på att man inte transporterar själva NADH-molekylen över mitokondriemembranet, utan i stället sker en serie reaktioner.
Den ena vägen heter malat-aspartatskytteln, och gör så att en NADH utanför mitokondrien omvandlas till en NADH inuti mitokondrien. Den har dock nackdelen att den bara fungerar när det finns mycket NADH i cytosolen.
https://sv.wikipedia.org/wiki/Malat-aspartatskytteln
Den andra heter glyserolfosfatskytteln. Den är mindre effektiv, eftersom den leder till att en NADH i cytosolen omvandlas till en FADH2 i mitokondrien (och FADH2 ger ju mindre ATP än NADH), men den kan användas även om det är ont om NADH i cytosolen.
https://en.wikipedia.org/wiki/Glycerol_phosphate_shuttle (jag hittade tyvärr ingen sida på svenska).
Eftersom det bildas 2 NADH i cytosolen när en glukosmolekyl går genom glykolysen skiljer det alltså 2 ATP beroende på om man räknar med malat-aspartatskytteln eller glyserolfosfatskytteln.
Att många källor uppger 30/32 molekyler ATP från en glukosmolekyl beror på att siffrorna 36/38 bygger på att man antar att man har en "perfekt" mitokondrie, med membran som aldrig läcker och där inga H+ kan passera utan att det är meningen. I verkligheten läcker mitokondriemembranet lite, och man får alltså inte fullt utbyte av alla H+ som har pumpats över, och då är 30/32 närmare det realistiska utbytet.
Hur har vår syn på atomen utvecklats genom historien och vilka atommodeller är de viktigaste att känna till samt kunna beskriva inom gymnasiekemin?
Det finns många olika modeller men jag skulle säga att de som är viktigast att känna till är:
- Demokritos atommodell. Detta är en av de allra första beskrivningarna av att världen skulle kunna vara uppbyggd av små, odelbara saker, partiklar om du vill. Sen att atomen faktiskt är delbar var en senare upptäckt, och en faktisk upptäckt. Nu snackar vi om rika grekiska män som sitter och filosoferar kring hur världen fungerar utan att ha några egentliga bevis för över 2000 år sedan.
- Bohrs atommodell. Nu får vi spola fram till början av 1900-talet. Här har vi fått en beskrivning av atomen som säger att det finns en positiv atomkärna med negativa elektroner som kretsar runt den i bestämda banor likt planeterna gör runt solen. Det här är den klassiska atommodellen som du ser i alla kemiböcker från gymnasiet, på illustrationer och i tv-serier som The Big Bang Theory. Den är också felaktig, men den fyller två viktiga funktioner: Den är relativt lättbegriplig och fungerar för att förklara grundläggande fenomen, vilket gör att man använder den inom gymnasiekemin. För det andra så beskriver den att elektronerna finns i bestämda energinivåer och att man måste ge en elektron en väldigt exakt mängd energi (t.ex. i form av ljus) för att den ska kunna hoppa till en högre energinivå. Sammantaget kan modellen beskriva saker som uppbyggnaden hos molekyler och joner av de lätta grundämnena, absorptionsspektra och emissionsspektra (på svenska: varför man t.ex. får olika färger hos fyrverkerier beroende på vilka metallsalter de innehåller, eller när man håller ett metallsalt i en gaslåga).
- Den kvantmekaniska atommodellen. Det här är den mest korrekta modellen vi känner till idag. Den löser diverse problem som dyker upp med Bohrs modell. T.ex. skulle det avges strålning ifall elektroner kretsade runt atomkärnan och det skulle göra att de tappade energi och föll in i atomkärnan. Det händer uppenbarligen inte, vilket innebär att Bohrs modell är felaktig. Den löser även problemet med Heisenbergs osäkerhetsprincip, vilken säger att man inte kan känna till den exakta rörelsemängden (eller hastigheten) och en exakt position hos en partikel på en och samma gång. En elektron som kretsar i en bana runt atomkärnan måste ha en väldigt exakt hastighet för att inte rubba rörelsemönstret, men den måste också ha ett bestämt avstånd till kärnan. Detta går alltså inte ihop enligt Heisenbergs osäkerhetsprincip. Man kan bara säga att det finns en viss sannolikhet att elektronen befinner sig på ett visst ställe, men aldrig exakt var den befinner sig. Detta har gett upphov till begrepp som ”elektronmoln” vilket ofta dyker upp inom kemin. Om något ”drar i elektronmolnet” betyder det helt enkelt att det är mer sannolikt att en elektron ska befinna sig på det stället.
Det finns såklart många andra steg som har tagits under de tusentals år som punkterna omfattat, men enligt mig är dessa modeller de viktigaste att känna till inom kemin.
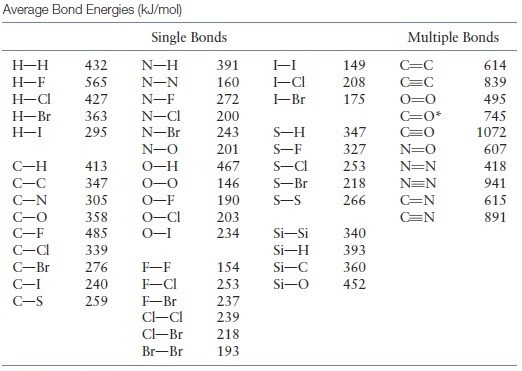
Hur använder jag bindningsenergier för att uppskatta hur mycket energi som frigörs i en reaktion?
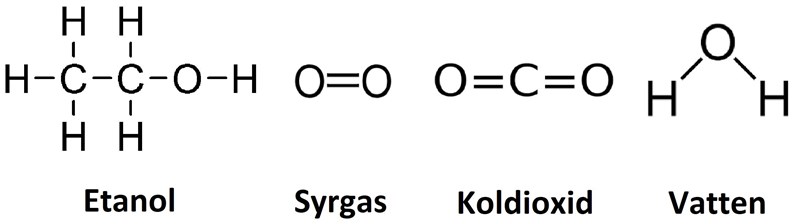
Låt oss ta ett exempel där vi vill uppskatta hur mycket energi vi kan få ut från förbränning av etanol, t.ex. i en etanoldriven miljöbil. Vi kan anta att etanol genomgår fullständig förbränning enligt:
Utöver det har vi även tillgång till följande bindningsenergier:
Det första vi behöver ta reda på är hur atomerna sitter ihop i molekylerna, eftersom det påverkar vilka bindningar vi behöver ta hänsyn till. Vi ritar upp ämnenas strukturformler:
I den balanserade reaktionsformeln ser vi att det finns 1 mol etanol, 3 mol syrgas, 2 mol koldioxid och 3 mol vatten. För att beräkna hur mycket energi som frigörs vid förbränningen, kan vi studera skillnaden mellan den energi som krävs för att bryta bindningarna i reaktanterna och den energi vi får ut genom att skapa nya bindningar i produkterna.
I 1 mol etanol har vi 5 mol C-H bindningar, 1 mol C-C bindningar, 1 mol C-O bindningar och 1 mol O-H bindningar. I 3 mol syrgas har vi 3 mol O=O bindningar. Vi summerar dessa bindningsenergier:
Det kostar oss alltså 4 722 kJ att bryta alla bindningar i 1 mol etanol och 3 mol syrgas. Nästa fråga är då hur mycket energi vi kan frigöra genom att skapa de nya bindningarna hos produkterna. Vi skapar 2 mol koldioxid som totalt sett innehåller 4 mol C=O bindningar samt 3 mol vatten som innehåller totalt 6 mol O-H bindningar:
Med andra ord frigör vi för varje mol etanol som förbränns. Reaktionen är exoterm och har en ungefärlig reaktionsentalpi på -1060 kJ/mol etanol.
Det här visar ett sätt att uppskatta hur mycket energi som frigörs. Om vi jämför med det experimentellt uppmätta värdet på reaktionsentalpin så motsvarar det -1367 kJ/mol etanol. Nästan 30 % mer än vårt beräknade värde! Varför finns det en så pass stor skillnad?
En viktig förklaring till skillnaden är att de bindningsenergier som anges i tabeller motsvarar medelvärden. En O-H bindning i vatten är exempelvis inte lika stark som en O-H bindning i etanol. Bindningsstyrkan i en C-H bindning påverkas ifall det finns elektronegativa atomer i molekylen eller inte. Vi antar också att etanol och vatten befinner sig i gasfas och att det inte finns några attraktioner mellan molekylerna. Sammantaget ger detta avvikelser jämfört med det teoretiskt beräknade värdet.
En alternativ och mer träffsäker metod är att använda bildningsentalpier i beräkningarna. Dessa värden är experimentellt framtagna och metoden ger unika värden för varje kemisk förening. Metoden med bindningsenergier passar däremot bra för att få en uppskattning av storleken hos energiförändringen (här: runt 1 MJ/mol) samt ifall det är en exoterm eller endoterm reaktion.
Varför behövs en kopparspik ifall det är vätejoner som reduceras i ett citronbatteri?
Normalt består ett citronbatteri av två elektroder - en anod/minuspol av zink och en katod/pluspol av koppar. I vissa exempel används järn som anod istället för zink. Citronsaften fungerar som elektrolyt och transporterar laddning i form av joner mellan elektroderna så att den elektriska kretsen sluts.
Batteriet bygger på att zink oxideras och bildar zinkjoner som sedan löses upp i citronsaften. Elektronerna kan då vandra genom en yttre krets där de utför arbete (exempelvis genom att driva en elmotor) vidare till kopparelektroden. Eftersom elektroden består av kopparatomer som inte kan reduceras ytterligare ges elektronerna istället till vätejoner i citronsaften. De reduceras då till vätgas.
Kopparelektrodens viktigaste uppgift är att transportera elektronerna ner i citronen så att de kommer fram till citronsaften och vätejonerna. Det är också viktigt att man använder en metall som är ädlare än zink. Ifall metallen var mindre ädel (t.ex. aluminium) skulle den avge elektroner och bilda minuspol istället för zinkelektroden. Ifall man använder zink till båda elektroderna så är de lika benägna att avge elektroner och man får två minuspoler men ingen pluspol. Det går inte att skapa ett sådant batteri eftersom potentialskillnaden (spänningen) blir 0 volt. Det hade däremot gått att använda en metall som är ädlare än koppar såsom silver eller guld till pluspolen, men dessa metaller är betydligt dyrare och därför mindre lämpade som elektrodmaterial.
Fördjupning för de som vill veta mer:
Lägger man ihop de två halvcellsreaktionerna fås följande nettoreaktion:
Notera att denna reaktion också kan ske ifall man låter en bit zink komma i kontakt med en sur lösning även om det inte finns någon annan elektrod. Zinkelektroden kan alltså på egen hand reagera med vätejonerna i citronsaften utan att elektronerna behöver vandra genom en yttre krets. Detta är ett exempel på självurladdning, d.v.s. en oönskad reaktion som minskar batteriets livslängd.
Varför vandrar elektronerna till kopparelektroden ifall de kan reagera direkt med zinkelektroden? Det beror till stor del på något som kallas för överpotential. Eftersom de positiva zinkjonerna som bildas repellerar positiva vätejoner i lösningen kommer de inte i kontakt med zinkatomerna lika lätt som vid kopparelektroden. Detta kallas för koncentrationsöverpotential. Det är också svårare än det ”borde vara” att bilda vätgas på just en zinkyta. Man säger då att zink har en hög bubbelöverpotential för vätgas. Det är alltså lättare för vätgasbubblor att växa till på kopparelektrodens yta.
Just bubbelöverpotentialen gör att det krävs en ganska kraftigt sur lösning (citron) för att vätejonerna ska börja reagera med zinkatomerna direkt vid zinkelektroden. En surare citron gör också att det finns en högre koncentration av vätejoner vid kopparelektroden vilket ger en högre spänning enligt Nernsts ekvation.
Hur fungerar atomorbitaler och hur skiljer de sig från modellen med elektronskal?
På gymnasiet delar man ofta in elektronerna i olika skal som kallas K, L, M, N osv. där skalen kan rymma ett ökande antal elektroner. Man säger att atomerna strävar efter ädelgasstruktur vilket innebär att de omges av åtta valenselektroner. Denna modell är användbar för de lätta grundämnena i de två första perioderna, alkalimetallerna, alkaliska jordartsmetaller, halogener och ytterligare några grupper i det periodiska systemet. Den kan däremot inte förklara saker som varför övergångsmetaller som koppar eller järn inte tycks sträva efter ädelgasstruktur. Den kan heller inte förklara varför vissa atomer kan omges av fler än åtta valenselektroner.
En mer komplett förklaringsmodell bygger på s.k. atomorbitaler. Den bygger på att man behöver fyra olika kvanttal för att beskriva elektronerna i en atom:
- Huvudkvanttal, ungefär det man kallar skal på gymnasiet. Förkortas ofta med ett heltal 1, 2, 3 osv som motsvarar K, L, M osv.
- Bankvanttal, det kan man se som ett slags undernivåer till skalen. De skrivs också med heltal (från 0 och uppåt, men alltid lägre än huvudkvanttalet) men brukar förkortas med bokstäver istället: s, p, d och f
- Magnetiskt kvanttal. Dessa beskriver ungefär hur orbitalerna är orienterade runt atomkärnan. Varje bankvanttal kan paras ihop med magnetiska kvanttal från 0 upp till +/- bankvanttalet. Om man har bankvanttalet 0 (vilket motsvarar det man normalt kallar s) så finns bara det magnetiska kvanttalet 0. Om man har bankvanttalet 1 (normalt kallat för p) finns de magnetiska kvanttalen -1, 0 och 1. Eftersom det bara finns ett tal i första fallet finns bara en uppsättning av s-orbitaler (per huvudkvanttal) men tre uppsättningar av p-orbitaler (som man i sin tur brukar kalla px py och pz). Motsvarande princip gäller för d och f-orbitalerna som finns i fem respektive sju uppsättningar.
- Spinnkvanttal. Elektroner kan bara ha talen -1/2 eller 1/2 och det finns en kvantmekanisk regel (Paulis uteslutningsprincip) som förbjuder elektroner i samma orbital att ha samma spinnkvanttal. Det innebär att man bara kan ha två elektroner i en och samma orbital, som dessutom måste ha motsatt spinn. Det får till följd att s-orbitalen rymmer maximalt 1*2=2 elektroner, p-orbitalerna 3*2=6 elektroner, d-orbitalerna 5*2=10 elektroner och f-orbitalerna 7*2=14 elektroner.
Det låter ganska krångligt men om man tittar på t.ex. klor så skulle man med skalteorin säga att K-skalet rymmer 2 elektroner, L-skalet 8 elektroner och M-skalet har 7 elektroner som utgör atomens valenselektroner.
Med orbitalteori skulle man säga att klor har en 1s-orbital med två elektroner, en 2s-orbital med två elektroner, tre 2p-orbitaler med sex elektroner, en 3s-orbital med två elektroner och tre 3p-orbitaler med 5 elektroner. Elektronerna i 3s och 3p utgör kloratomens 2+5=7 valenselektroner. Där ser du också att huvudkvanttalet som skrivs i början hör ihop med det man brukar kalla för skal. De orbitaler med högst huvudkvanttal (i detta fall 3) utgör atomens valensskal.
När man skriver elektronkonfigurationen för klor görs det på följande sätt:
1s22s22p63s23p5
Den upphöjda siffran beskriver antalet elektroner i en viss sorts orbital. Här kan man även notera att förledet 1s22s22p6 beskriver elektronfigurationen hos ädelgasen neon (Ne). Det går därför att förenkla elektronkonfigurationen hos klor genom att använda s.k. ädelgasnotation:
[Ne]3s23p5
Beteckningen innebär att klor har samma elektronkonfiguration som neon, samt ytterligare 3s och 3p-orbitaler som innehåller totalt sju elektroner. På så sätt åskådliggör man bara atomens valenselektroner vilka normalt är de som har betydelse vid kemiska reaktioner.


