Beräkna värdet på vattnets kokpunkt
Hej! Jag lyckades inte lösa följande uppgift:
"Vilket värde på vattnets kokpunkt får man utifrån vattnets ångbildningsentalpi samt systementropin hos flytande vatten och vattenånga?"
Facit: "ΔG = ΔH – TΔS = 0 🡺 T = ΔH/ΔS = 44000/(189 - 69,9) = 369 K = 96 °C"
I facit ser jag att man använt Gibbs fria energi men jag undrar ändå en sak. Jag räknar ut att förångningsentalpin är ca 41000 J/mol, inte 44000 som facit säger.
Jag räknar så här: förångningsentalpi i J/kg / (antal g i ett kg / vattens molmassa i g/mol)
Vilket ger 2260000/(1000/18,02) = 40680 J/mol. Är det rätt?
Den slutgiltiga temperaturen blir dock helt konstig i så fall. Vattnets kokpunkt blir ca 71 °C.
Hejsan,
Jag förstår faktiskt inte vad det är du har beräknat. Kan du utveckla? (Matematiskt eller i ord)
Om du fortsätter räkna på de värden du har erhållit och får ett värde på vattnets kokpunkt som avviker rejält så är det en liten varningsklocka för att dina beräkningar är way off. Varför använder du dig inte av Gibbs funktion?
I min formelsamling står det att ångbildningsentalpin för vatten är 2260000 J/kg. Jag vill omvandla detta till J/mol.
I 1 kg vatten finns (1000 g)/(18,02 g/mol) = 55,493895... mol.
Detta ger att ångbildningsentalpin för vatten = 2260000 J/kg = 2260000 J/55,493895... mol = 40680 J/mol
Nu har jag rätt enhet och kan fortsätta med resten av uppgiften.
Jag hämtar från min formelsamling att ΔS för H2O (g) = 189 J/(mol x K)
Jag hämtar från min formelsamling att ΔS för H2O (l) = 69,9 J/(mol x K)
Sedan använder jag formeln för Gibbs fria energi, precis på sättet som facit gjorde:
ΔG = ΔH – T x ΔS = 0 🡺 T = ΔH/ΔS = 40680/(189 - 69,9) = 342 K = 69 °C
Att jag fick 71 °C i förra beräkningen beror på avrundningsfel.
Anledningen till att man sätter ΔG = ΔH – T x ΔS = 0 är för att 0 är gränsen för en spontan process. Allt under 0 är en spontan process.
Zeus skrev:I 1 kg vatten finns (1000 g)/(18,02 g/mol) = 55,493895... mol.
Detta ger att ångbildningsentalpin för vatten = 2260000 J/kg = 2260000 J/55,493895... mol = 40680 J/mol
Då får du ju uträkningen i fel enheter:
Jag hade tänkt så här:
Men vilket som, när jag googlar snabbt så ser jag att du har fått fel värde på din förångningsentalpi.
Pikkart skrev:Zeus skrev:I 1 kg vatten finns (1000 g)/(18,02 g/mol) = 55,493895... mol.
Detta ger att ångbildningsentalpin för vatten = 2260000 J/kg = 2260000 J/55,493895... mol = 40680 J/mol
Då får du ju uträkningen i fel enheter:
Jag hade tänkt så här:
Men vilket som, när jag googlar snabbt så ser jag att du har fått fel värde på din förångningsentalpi.
Nej, jag får ju rätt enhet. Jag råkade använda 18 g/mol som molmassa trots att jag skrev ut 18,02 i mitt inlägg. Jag har två olika formelsamlingar som säger olika. Hur som helst, om jag räknar som jag skrev d.v.s. 2260000/55,493895 så får jag precis samma svar som du, 40730 J/mol.
Jag vet inte varför du skriver att detta är fel värde på förångningsentalpi. Enligt Wikipedia så verkar värdet som vi fått fram stämma rätt så bra (se tabellens sista rad):
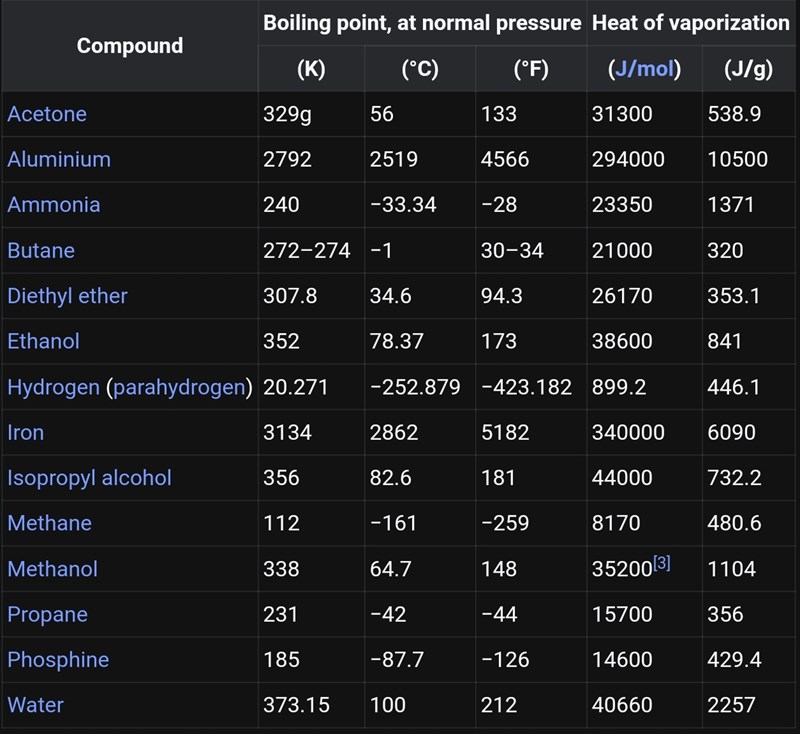
Källa: https://en.m.wikipedia.org/wiki/Enthalpy_of_vaporization
Nej, jag får ju rätt enhet. Jag råkade använda 18 g/mol som molmassa trots att jag skrev ut 18,02 i mitt inlägg. Jag har två olika formelsamlingar som säger olika. Hur som helst, om jag räknar som jag skrev d.v.s. 2260000/55,493895 så får jag precis samma svar som du, 40730 J/mol.
Jag vet inte varför du skriver att detta är fel värde på förångningsentalpi. Enligt Wikipedia så verkar värdet som vi fått fram stämma rätt så bra (se tabellens sista rad):
Källa: https://en.m.wikipedia.org/wiki/Enthalpy_of_vaporization
Nej, det får du inte. Jag kan ju inte bortse för att det är ett lyckligt sammanträffande men du visar inte in dina uträkningar om HUR du får "J/mol", vilket är väldigt viktigt. Det du har visat är att du får "J/Kg/mol, INTE "J/mol", kolla noga igenom dina beräkningar så ser du att det är väldigt tydligt.
Hur som, om du scrollar upp på till höger hörn på samma källa du angav så ser du ett temperatursberoende. Det värdet du räknar på är entalpin hos vatten vid 100 grader, du vill räkna på den runt rumstemperatur.
Baserat på frågan så förutsätter jag att de vill att du räknar på den hos vatten runt rumstemperatur, vilket innebär att du måste tillsätta x enheter energi till vatten med x grader för att omvandla det från flytande form till gasfas.



