Galvanisk Cell
Hej!
Min lärare har förvirrat mig totalt när det gäller elektrokemi och känner att jag knappt förstår något. Skulle någon kunna förklara skillnad på elektrolys och galvanisk cell. Jag har förstått att galvanisk cell är ett kemiskt batteri men elektrolys är tvärtom alltså att det sönderdelas. vet inte riktigt känner mig helt borta. Och anod och katod är anod alltid minuspol och är oxidation och katod pluspol och är reduktion?
Frågan: Glvanisk cell som genererar 3,8 V, skriv begrepp osv
Du verkar ha fattat den viktigaste skillnaden: I en galvanisk cell sker det en spontan reaktion (där man kan "lura" elektronerna att ta en omväg, så att man kan använda elektriciteten) och en elektrolys är där man tvingar en reaktion att gå baklänges jämfört med vad den skulle göra spontant, genom att tvinga på den el-energi.
Smaragdalena skrev:Du verkar ha fattat den viktigaste skillnaden: I en galvanisk cell sker det en spontan reaktion (där man kan "lura" elektronerna att ta en omväg, så att man kan använda elektriciteten) och en elektrolys är där man tvingar en reaktion att gå baklänges jämfört med vad den skulle göra spontant, genom att tvinga på den el-energi.
Men är anod alltid negativt och en oxidation och är katod alltid pluspol och en reduktion?
Men vad gör allt detta och vad använder man detta till? Känner mig som sagt väldigt borta. Hur ska man veta vilket som är katod och anod osv? Går elektronerna alltid anod eller hur är det?
Lär dig PANK-regeln: positiv anod, negativ katod. Då handlar det om elektrolys. Negativa joner dras mot anoden (därför kallar man ibland negativa joner för anjoner). Positiva joner dras mot katoden (därför kallas de ibland för katjoner). Elektrolys används t ex för att framställa aluminium (Island, som har gott om billig elenergi, importerar råmaterialet bauxit och exporterar aluminium. Det ör i princip ett sätt för Island att exportera el utan att behöva bygga en elkabel för det.) Ett annat exempel är att man nu försöker framställa järn ur järnmalm utan att behöva använda kol (och därmed släppa ut koldioxid) genom att använda vätgas som reduktionsmedel istället - och vätgas framställer man genom elektrolys av vatten, och för att få ihop all el som behövs för detta planerar man att bygga massor av vindkraftverk.
Smaragdalena skrev:Du verkar ha fattat den viktigaste skillnaden: I en galvanisk cell sker det en spontan reaktion (där man kan "lura" elektronerna att ta en omväg, så att man kan använda elektriciteten) och en elektrolys är där man tvingar en reaktion att gå baklänges jämfört med vad den skulle göra spontant, genom att tvinga på den el-energi.
Är detta varför vissa batterier kan bli laddade och vissa inte?
För de batterier som kan laddas (det fungerar inte med alla sorter) så är det en elektrolys när man laddar dem.
När det handlar om galavniska celler säger man alltså inte termen anod och katod? Kollade precis på en video och han nämnde aldrig katod och anod. Bara att i - polen sker det en oxidation och + polen en reduktion?
Naturareelev skrev:När det handlar om galavniska celler säger man alltså inte termen anod och katod? Kollade precis på en video och han nämnde aldrig katod och anod. Bara att i - polen sker det en oxidation och + polen en reduktion?
Korrekt. Termerna anod och katod här ihop med elektrolys.
Åh tack! Tacksam för dina tydliga svar då min lärare är den mest oklaraste läraren som jag har bevittnat under alla mina skolår.
(Jag har fördelen att jag kan sätta mig och googla en stund innan jag svarar, det kan inte din lärare göra när du frågar. Det är inte alltid det behövs, men ibland, så...)
Smaragdalena skrev:(Jag har fördelen att jag kan sätta mig och googla en stund innan jag svarar, det kan inte din lärare göra när du frågar. Det är inte alltid det behövs, men ibland, så...)
Sista gången nu förlåt för tjat
Galvanisk cell: (-) pol och där sker en oxidation och (+) pol sker det reduktion
Elektrolys tvärtom: katod är negativ och där sker i katodreaktionen sker en reduktion och anod är positiv och där sker den en oxidation.
I ett batteri (d v s en galvanisk cell) går strömmen från + till - i ledningen, d v s elektronerna lämnar den galvaniska cellen vid -polen och går in i den galvaniska cellen vid +polen.
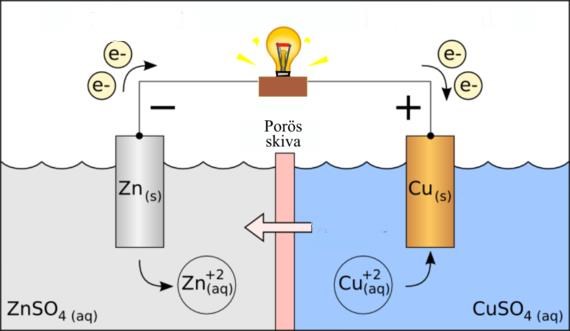
Okej det förstår jag nu tack, men i en elektrolys är det en odixation istället vid + pol alltså anoden och reduktion i - pol?
För som vi ser på bilden är det tvärtom i galvanisk cell. Elektrolys är alltså från + till -, medans galvanisk cell är från - till +
Det som är på bilden är en galvanisk cell - det sker en spontan kemisk reaktion som får elektronerna att röra sig genom den elektriska ledaren (och därför lyser lampan). En elektrolys går baklänges genom att man tvingar den till det med hjälp av elektriciteten.



