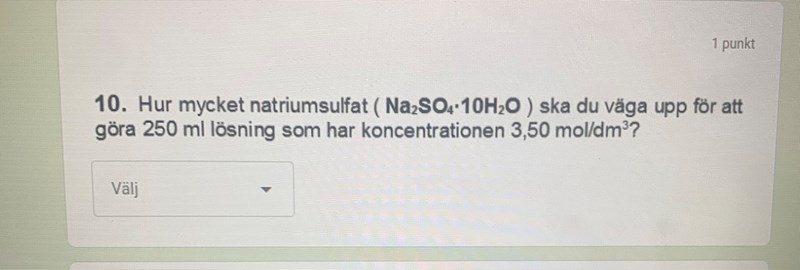
Koncentrationer uträkning
 Hej, jag undrar bara vad gångertecknet betyder i formeln?
Hej, jag undrar bara vad gångertecknet betyder i formeln?
laros skrev:Din fråga har blivit besvarad här.
Måste jag räkna med vattenmolekylerna i uträkningen då?
Har du klickat in dig på länken som Teraeagle kommenterade? Där är det beskrivet väldigt bra.
Edit: Det blev fel när jag klistrade in så klicka in dig här och sök på frågan "Vad betyder multiplikationstecknet i vissa kemiska formler?" Där har Teraeagle svarat på frågan utförligt.
Vad betyder multiplikationstecknet i vissa kemiska formler?
Först och främst är det inte ett multiplikationstecken, utan ett sätt att beskriva kristallstrukturen hos ämnet. Det vanligaste exemplet är CuSO4⋅5H2OCuSO4·5H2O, vilket anger att det finns vattenmolekyler inlåsta i kristallstrukturen hos CuSO4CuSO4. När saltet en gång var i vattenlösning, blev några vattenmolekyler kvar runt jonerna efter indunstning då de attraherar varandra elektrostatiskt eller är sammanbundna till komplexföreningar. Om man vill beräkna molmassan för CuSO4⋅5H2OCuSO4·5H2O, ska man summera molmassan hos CuSO4CuSO4 samt fem molmassor av H2OH2O.Skrivsättet är väldigt vanligt inom vissa områden som metallurgi, där det kan beskriva uppbyggnaden hos vissa föreningar på ett tydligare sätt. Ca3Si2O7Ca3Si2O7 kan exempelvis skrivas som 3CaO⋅2SiO23CaO·2SiO2, vilket betyder att föreningen består av tre delar CaOCaO och två delar SiO2SiO2. - Teraeagle
Min gissning är att det skrivsättet har hittats på av någon som bodde i ett land där man använde ett litet som multiplikationstecken, inte ett - i så fall var ju ledigt!
Jag brukar tycka om att kolla på enheten av det jag vill ha, och dela upp uppgiften därifrån. Så för att hitta koncentrationen mol/dm3 så kan vi börja med att få ut antalet mol. För detta kan du titta på din molekyl och hitta molmassan för varje enskild ämne i den. Dessa hittar du i periodiska systemet, t.ex kol har molmassan 16 g/mol.
Så i din uppgift är natriumsulfatet som används hydrerat (alltså vatten är med, ofta fallet i kristaller till exempel). Så när det är skrivet sådär med *H2O kan vi dela upp det att räkna ut Na2SO4 för sig, och vatten för sig.
För Na2SO4
2xNA
1xS
4xO
För vatten (H2O)
1xH
2xO
Molmassan hittar du i det periodiska systemet.
När du har tagit reda på molmassan, har du molmassan för Na2SO4 genom att addera allt det du fick från tabellen jag skrev innan. Sedan adderar du det men 10 gånger vattnens molmassa. Då får du den totala molmassan för molekylen i g/mol, men nu vill vi ha det i g/dm3. För att få ut hur många gram kan man försöka kolla på enheterna och ställa upp en ekvation. Vi kan börja med att få bort dm³, så dm³ är faktiskt samma liter. Så vi kan göra om 250 ml till dm³ genom att multiplicera 250 med 10⁻³, då får vi att 250ml = 0.25 liter.
Vi måste bli av med dm³ eller liter från 3.50mol/dm³, och vi har mängden i liter(eller dm³) för att bli av med dm³ i nämnaren kan man multiplicera med dm³. Då har du X mol kvar.
3.50(mol/dm³)*slutvolym(dm³) = X mol, där slutvolym innebär den volymen du vill ha i slutet, d.v.s 0.25liter.
Sedan när du fått ut X mol så kan du multiplicera det till din sammanräknade molmassa (g/mol) för att få ut ett svar i g. Detta är då massan på natriumsulfat du behöver. Hoppas det hjälpte.


