Kvantfysik - vilken är vätespektrum?

Om man har aldrig sett en emissionspektrum för väte hur kan man veta det, eftersom jag tänkte på bohr postulat (hf=Wn - Wm där n är större än m) men jag vet inte f, Wn eller Wm?
Väteatomens energinivåer ges av
Där konstanten C är djupet på brunnen, dvs ungefär . Det viktiga är att notera att man ska dela med . Det innebär att ju högre energi, desto tätare ligger energinivåerna. Detta gäller för alla vätets serier (Paschen, Balmer, Lyman). I det här fallet är det Balmer du ska känna igen. Du ska alltså leta efter ett diagram där högre energi => tätare nivåer. Åt vilket håll blir energin högre i diagrammen ovan? Vilket av diagrammen har täta linjer vid höga energier och sedan längre och längre mellan linjerna?
(Och jo, du behöver känna till det karaktäristiska utseendet hos vätespektrat, annars är uppgiften mycket svår)
Hemskt dålig uppgift.
Med uteslutningsprincipen tror jag att alla faller bort...

Spektrum av väte, där jag flippade skalan från https://commons.wikimedia.org/wiki/File:Emission_spectrum-H.svg
Egentligen säger alla att vätespektrum innehåller fyra synliga linjer: Balmerlinjerna.
En lite mer välvillig tolkning av det "synbara" spektrat "Lines five and six can be seen with the naked eye, but are considered to be ultraviolet as they have wavelengths less than 400 nm."

Håller med Peter Kuiper. Inga av de där är ju vätes synliga spektrumet även efter att man töjer på definitionen.
Finns en del övergångar i ultravioletta bandet ganska nära violetta [som D4NIEL uppmärksammar samtidigt som jag skriver]
Men då borde det ju inte vara ett tomrum i högra maginalen till c) utan vara två linjer där. Godtyckligt att ta med den starka ultravioletta och lämna ute den svaga ultravioletta. Men kanske är naturligt om man gjort labben. Kanske är lätt att se den 5:e men omöjligt att se den 6:e under labsalsomständigheter och en gitterspektrometer.
Om Anders Ångström inte såg den femte linjen då ska man nog inte betrakta den som synlig. Dessa kunde man egentligen bara se med fotografiska tekniker.
Från en artikel av Macrae (2013):
Pieter Kuiper skrev:Om Anders Ångström inte såg den femte linjen då ska man nog inte betrakta den som synlig. Dessa kunde man egentligen bara se med fotografiska tekniker.
Vilket ljus som är synbart skiljer sig naturligtvis mellan människor och Ångström är ingen absolut referensperson. Det finns en formell definition härledd från ett genomsnittligt öga men verkligheten är en annan:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4763133/#!po=44.5455
"I could image the slit of a double monochromator down to 310 nm, and I was certain that I was truly imaging 310 nm and not stray light of longer wavelengths as I placed a number of spectral filters in the beam with no change in detection threshold. But today, at age 74, I cannot even see 400 nm very easily!"
Oavsett vad en fruktansvärt klantigt formulerad uppgift i min mening.
Spektrum c) stämmer bättre med litium: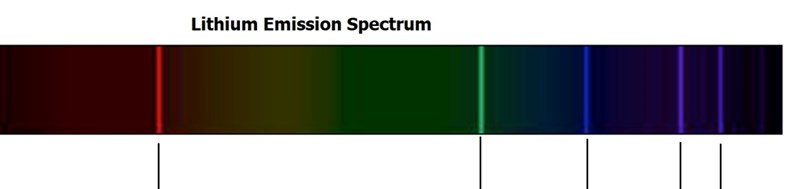 Men utan skala är det omöjligt att säga något. Rydbergserier är vanliga, kan ligga i olika våglängdsområden.
Men utan skala är det omöjligt att säga något. Rydbergserier är vanliga, kan ligga i olika våglängdsområden.
Här en gammal fotografisk upptagning av Balmer-linjerna (där fem linjer betecknas med bokstav): (källa)
(källa)




