Lewis struktur av molekyler
Jag är förvirrad över reglerna som gäller:
en källa säger att varje atom som deltar i en bindning ska delta med en elektron - men samtidigt så hittar jag tex denna bilden, och om syre har 6 valenselektroner hur går detta ihop då om den deltar med en i bindningen, det blir ju sju stycken elektroner?
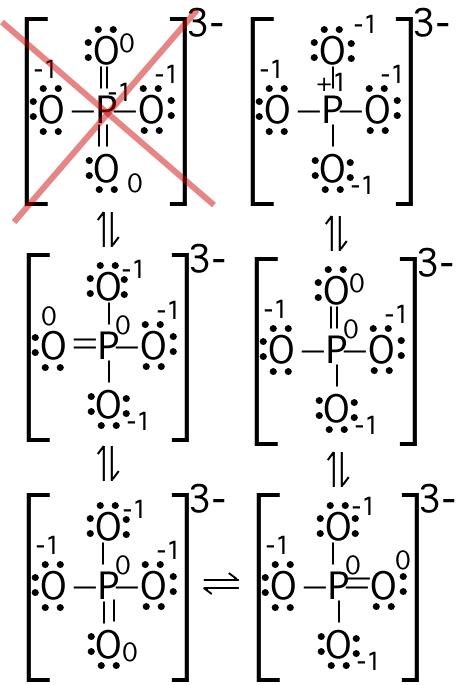
En syreatom med laddningen -1 har 7 elektroner, inte 6.
Smaragdalena skrev:En syreatom med laddningen -1 har 7 elektroner, inte 6.
Tror inte du förstod min fråga.
Syre har normalt 6 valanselektroner. Enligt den källa jag hittade om hur man ritar Lewisstrukturer ska varje atom bidraga med 1 elektron till en bindning (så mellan tex P och O ska P ge 1 av sina valanselektroner och O ge 1 av sina.
Men om man kollar på syre tex längst upp till höger så har den 7 elektroner som deltar i ensamma par och bindningar. Jag får inte detta att gå ihop med källans information, vilket jag tolkade som att man måste använda en atom's valanselektroner för att få oktetten att gå ihop (så har man som kol 4st får man använda varje elektron till att "få en extra" genom att låta den valanselektroner delta i en bindning som gör kolet får räkna bindningen som 2 elektroner och med det får 4*2=8 valanselektroner - men man kan ju inte bara rita dit elektroner på kolet när den är i en förening och ska rita lewisstruktur).
Varje atom måste inte bidra med en bindningselektron. En atom kan även bidra med båda elektronerna och då kallas den för dativbindning (”dative bond”). I kommer t ex inte en enda elektron i de fyra bindningarna från aluminiumatomen.
Hur jag än letar bland alla Lewisstrukturerna, så hittar jag ingen syreatom som inte har 8 elektroner omkring sig. Var hittar du en med bara sju?
Teraeagle skrev:Varje atom måste inte bidra med en bindningselektron. En atom kan även bidra med båda elektronerna och då kallas den för dativbindning (”dative bond”). I kommer t ex inte en enda elektron i de fyra bindningarna från aluminiumatomen.
Det kan mkt väl vara att jag tänker helt fel och missar något. Men om du kollar tex längst upp till höger så har det syret 6 elektroner i ensamma elektronpar + 1 elektron som den delar. Och detta är inte en dative bond. Hur går O-P bindningen ihop om O ska dela 1 elektroner för att göra bindningen - det skulle väl kräva 7 valanselektroner då för att se ut sådär?
Om du menar den översta syreatomen, så är den omgiven av 8 elektroner - 3 "egna" elektronpar och ett elektronpar, som den delar med fosforatomen. Syreatomen längst till höger är precis likadan. Ett bindnings-streck mellan två atomer betyder en elektronparbindning, alltså två elektroner.
Jag byter fråga (kanske faller på plats) - när man placerar ut elektronerna, ska man då se till att centralatomen har oktett först eller de mest elektronegativa?
Eller finns ingen sådant enkelt svar?
Om man ser till att fixa båda sakerna samtidigt, får man den struktur som är längst upp till höger. Den har nackdelen att den har en positivt laddad fosforatom bunden till 4 stycken negativa syreatomer. Alternativet är att man har en dubblebindning mellan fosforatomen och en av syreatomerna, vilket är de fyra andra resonansstrukturerna. Detta är möjligt eftersom det finns tillgång till d-orbitaler i fosforatomen. Den överkorsade strukturen är där negativa atomer är bundna till varandra, vilket är osannolikt. Nu har jag kallat det för laddade atomer, vilket inte är helt korrekt. Egentligen borde jag ha beskivit var man har en extra hög elektrondensitet istället, man jag är för lat för att formulera om mig.
Quacker skrev:Teraeagle skrev:Varje atom måste inte bidra med en bindningselektron. En atom kan även bidra med båda elektronerna och då kallas den för dativbindning (”dative bond”). I kommer t ex inte en enda elektron i de fyra bindningarna från aluminiumatomen.
Det kan mkt väl vara att jag tänker helt fel och missar något. Men om du kollar tex längst upp till höger så har det syret 6 elektroner i ensamma elektronpar + 1 elektron som den delar. Och detta är inte en dative bond. Hur går O-P bindningen ihop om O ska dela 1 elektroner för att göra bindningen - det skulle väl kräva 7 valanselektroner då för att se ut sådär?
Fosforatomen har fem valenselektroner. Den donerar två elektroner till det ena syret via en dativbindning. Övriga tre valenselektroner binder till varsin syreatom. De tre sistnämnda syreatomerna har varsin extra elektron som gör att jonen totalt har laddningen -3.



