Löslighet
Hej,
Jag har en 100 ml vattenlösning med NaH2PO4 med okänd koncentration. Det enda jag vet är att det finns väldigt lite salt i lösningen, mindre än 1 g.
Jag vill ta reda på koncentrationen. För att göra detta kan jag skapa en fällning, men jag måste då lägga till en positiv jon som binder till divätefosfatjonen. Eftersom koncentrationen av divätefosfat är så låg borde denna positiva jon + divätefosfatjon vara mycket olöslig, så att så mycket som möjligt av det lilla som finns faller ut.
Kan jag få förslag på lämplig positiv jon? Jag tänkte först Ag+ men jag hittar ingen info på nätet om lösligheten för AgH2PO4.
Edit: Om jag lägger till tillräckligt mycket av den positiva jonen kanske det inte krävs att det bildade saltet är särskilt olösligt, så länge jag tillsätter positiva joner tills att saltet slutar falla ut? Jag tänker på löslighetsprodukten: om man ökar en faktor tillräckligt mycket kommer reaktionen gå mycket till höger.
Det är enklare att fälla ut fosfatjoner, bestämma mängden fosfatjoner i fällningen och sedan beräkna hur mycket NaH2PO4 det motsvarar. Det finns ganska många svårlösliga fosfater, i stort sett varenda fosfat som inte innehåller ammoniumjoner eller alkalimetaller är svårlöslig. Börja med att neutralisera lösningen så att du får en lösning av natriumfosfat (t.ex. genom tillsats av natriumhydroxid). Sedan kan du tillsätta ett salt, t.ex. kalciumklorid för att fälla ut fosfatjonerna som kalciumfosfat. Det finns andra fosfater som har ännu lägre löslighet så det behöver inte vara just ett kalciumsalt (det behöver inte heller vara en klorid, huvudsaken är att det som tillsätts är vattenlösligt). Det man får tänka på är att lösningen inte får vara för basisk när man tillsätter reagenset, för då finns en risk att du fäller ut en hydroxidförening istället om hydroxidsaltet är mer svårlösligt är fosfatsaltet.
Teraeagle skrev:Det är enklare att fälla ut fosfatjoner, bestämma mängden fosfatjoner i fällningen och sedan beräkna hur mycket NaH2PO4 det motsvarar. Det finns ganska många svårlösliga fosfater, i stort sett varenda fosfat som inte innehåller ammoniumjoner eller alkalimetaller är svårlöslig. Börja med att neutralisera lösningen så att du får en lösning av natriumfosfat (t.ex. genom tillsats av natriumhydroxid). Sedan kan du tillsätta ett salt, t.ex. kalciumklorid för att fälla ut fosfatjonerna som kalciumfosfat. Det finns andra fosfater som har ännu lägre löslighet så det behöver inte vara just ett kalciumsalt (det behöver inte heller vara en klorid, huvudsaken är att det som tillsätts är vattenlösligt). Det man får tänka på är att lösningen inte får vara för basisk när man tillsätter reagenset, för då finns en risk att du fäller ut en hydroxidförening istället om hydroxidsaltet är mer svårlösligt är fosfatsaltet.
Tack! Jag tänkte också att man kunde fälla ut fosfatjon i stället.
Om alla divätefosfatjoner ska bli fosfatjoner tycker jag pH ska åtminstone vara 13. Menar du att det är för högt? Hur ska jag annars få en bra uppskattning av substansmängden divätefosfat?
Edit 1: Vänta - nu skrev jag fel
Edit 2: nu står det rätt
Om du har en lösning med lite mer rimligt pH, där det finns både fosfatjoner och vätefosfatjoner, så kan du ändå fälla ut fosfatet - när alla fosfatjoner är förbrukade, kommer fler vätefosfatjoner bli till fosfatjoner och så håller det på tills allt fosfat har fällts ut.
Smaragdalena skrev:Om du har en lösning med lite mer rimligt pH, där det finns både fosfatjoner och vätefosfatjoner, så kan du ändå fälla ut fosfatet - när alla fosfatjoner är förbrukade, kommer fler vätefosfatjoner bli till fosfatjoner och så håller det på tills allt fosfat har fällts ut.
Tack! En följdfråga: hur vet jag vad som är rimligt pH? 11? 10?
Till det kan ett s.k. distributionsdiagram vara hjälpsamt:
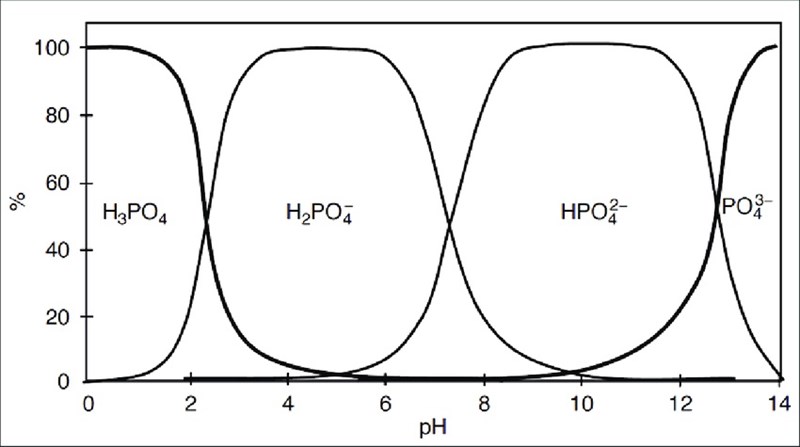
Teraeagle skrev:Till det kan ett s.k. distributionsdiagram vara hjälpsamt:
Jag har försökt men kommer inte på hur jag ska använda diagrammet för att veta hur hög pH bör vara.
Låt säga att jag tillsätter BaCl i lösningen för att fälla ut Ba2(PO4)3. Jag förstår att jag inte ska göra lösningen alltför basisk, för då finns risken att det fälls ut Ba(OH)2 i stället. Men just när det gäller bariumhydroxid så är det en stark bas som är mycket lösligt i vatten. Så då borde väl inte risken vara så stor att jag har för hög pH? Jag vill ju ändå ha relativt hög pH så att det som fälls ut verkligen är Ba2(PO4)3 och inte BaHPO4. För att säkerställa detta borde väl andelen PO43– vara större än andelen HPO4? Alltså att pH > 13.
Tack på förhand.
Det är inte något stort problem, huvudsaken är att Ba3(PO4)2 är den mest svårlösliga föreningen - då kommer den att fällas ut. Skulle säga att pH 13 verkar ganska rimligt i det fallet.
Teraeagle skrev:Det är inte något stort problem, huvudsaken är att Ba3(PO4)2 är den mest svårlösliga föreningen - då kommer den att fällas ut. Skulle säga att pH 13 verkar ganska rimligt i det fallet.
Kan jag i detta sammanhang förvänta mig att nästan 100 % av substansmängden PO43- fälls ut? För jag vill ju väga fällningen och göra en bra uppskattning av fosforsyralösningens koncentration.
Skulle även uppskatta tips på hur jag går tillväga för att väga fällningen. Dekantering sen torkning med värme?
(Och jag vet, jag har gjort tusen fel i siffrorna för antalet atomer i molekylerna.)
Ja om BaCl tillsätts i överskott kan du göra antagandet alla fosfatjoner fälls ut.
Dekantering kan fungera, ofta används filtrering för att få kristallerna. Och torkning med måttlig värme är lämpligt för att snabba på processen innan vägningen.




