Orbitalhybridisering
Hej! Har lite frågor om hybridisering mellan orbitaler. Jag förstår konceptet och vet hur olika typer fungerar sp, sp^2 samt sp^3. Men några saker undrar jag:
Orbitalhybridisering är ju vanligt bland grundämnena Be, B, C, N och O. Kommer dessa ämnen alltid vara hybridiserade i alla molekyler? Eller finns det fall där de inte är hybridiserade alls?
Sedan en fråga om kolatomer. Har fått veta att kol kan binda med två dubbelbindningar och samtidigt vara sp-hybridiserat. Alltså att den har två π-bindningar och två σ-bindningar. Och att varje dubbelbindning består av en σ- och en π-bindning. Så här:
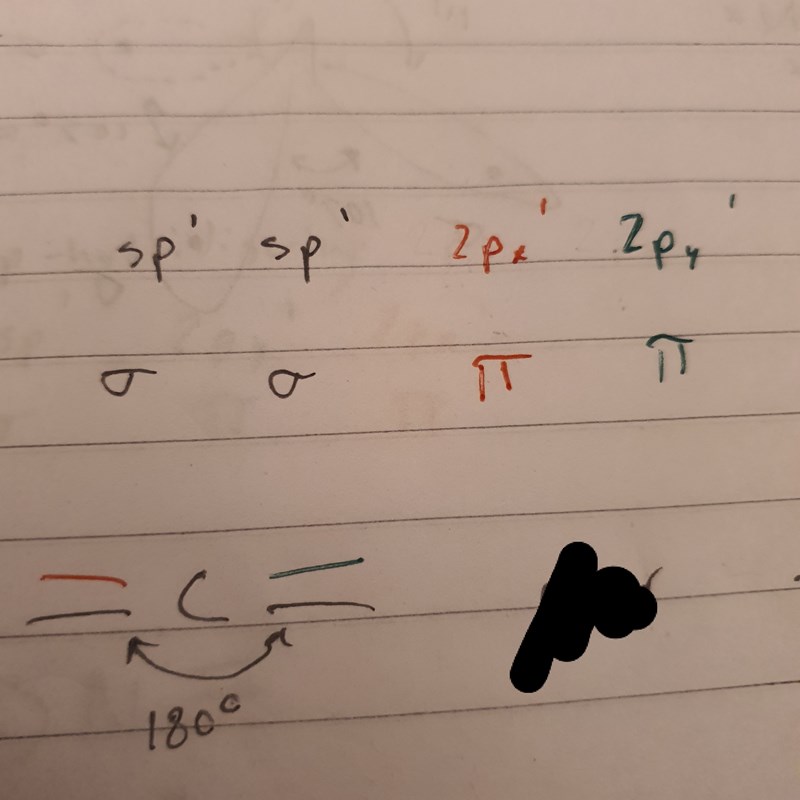
Problemet är att jag inte kunnat hitta exempel på någon molekyl med sådana kolatomer. Jag är inte heller säker på att jag kan tänka ut i 3d hur en sådan molekyl skulle se ut. Min gissning är att kolatomen binder till två andra atomer med varsin π-orbital, på bägge sidor om kolatomen, så alla π-orbitalerna förbinds.
Orbitalhybridisering är ju vanligt bland grundämnena Be, B, C, N och O. Kommer dessa ämnen alltid vara hybridiserade i alla molekyler? Eller finns det fall där de inte är hybridiserade alls?
Det där med hybridisering är ett begrepp man har infört för att förklara strukturen hos vissa molekyler. Ett bra exempel är H2O och H2S där vinkeln mellan väteatomerna i H2O är ca 104,5 grader medan den är 90 grader i H2S. Det kan man tycka är väldigt konstigt eftersom både syre och svavel har sex valenselektroner. Skillnaden är att syret är sp3-hybridiserat medan svavel inte är hybridiserat. Det påverkar vinklarna mellan orbitalerna. Med andra ord är det svårt att säga att det inte finns något exempel där ämnena du nämnde inte är hybridiserade. Om man hittar något ämne där bindningarna kan förklaras med hybridisering drar man slutatsen att hybridisering har skett. Jag kan i alla fall inte komma på något konkret exempel där dina ämnen inte är hybridiserade. Hybridisering kan ske och är sannolikt när det är ganska liten energiskillnad mellan orbitalerna som hybridiseras, vilket är fallet hos s och p hos de lätta grundämnena.
Sedan en fråga om kolatomer. Har fått veta att kol kan binda med två dubbelbindningar och samtidigt vara sp-hybridiserat. Alltså att den har två π-bindningar och två σ-bindningar. Och att varje dubbelbindning består av en σ- och en π-bindning.
En figur kan hjälpa:
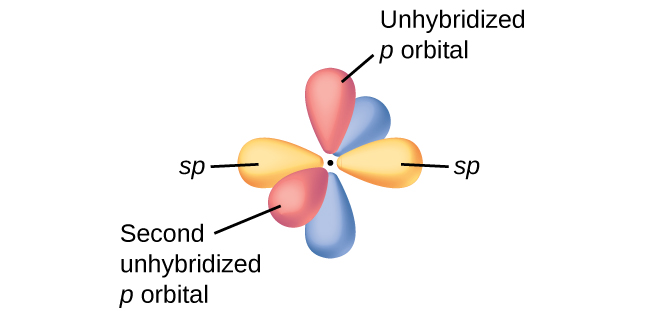
Det som händer är att kolatomen med två dubbelbindningar binder med ena sp-loben till en kolatom med en sigmabindning, medan två av p-loberna (uppe/nere eller fram/bak i figuren) binder till samma kol med en pibindning. Den andra sp-loben och de två resterande p-loberna binder till den andra kolatomen på samma sätt. Det innebär att bindningarna blir vinkelräta mot varandra, dvs ena bindningen blir "liggande" medan andra blir "stående".
Den här bilden är ännu bättre:
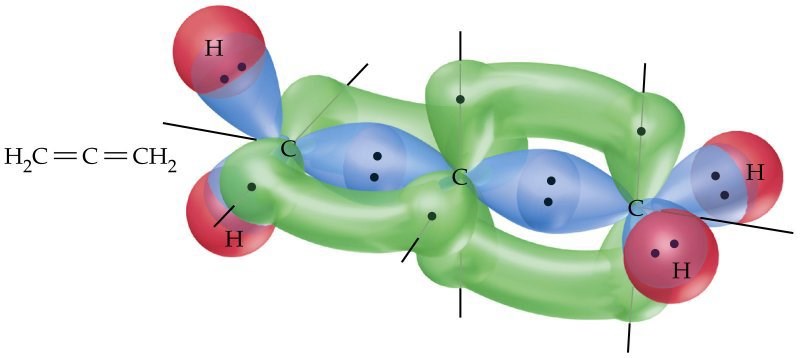
Tack! Det var så jag tänkte mig ungefär.
En sista fråga om hybridisering, hur vet jag vilka av orbitalerna som hybridiseras och vilka som blir π-bindning vid sp- och sp^2 hybridisering? D.v.s. när jag får välja mellan 2px 2py och 2pz? Bör jag tänka på riktningen för de kovalenta bindningarna? Min första teckning stämmer överens med din 3d-bild av molekylen. Där hade jag antecknat 2px och 2py som π-bindningar (från min lärares genomgång), vilket stämde med din bild. Men hur ska jag tänka för andra molekyler?
Det spelar ingen roll vilken av px, py och pz som du lämnar ohybridiserad. Benämningarna handlar mer om hur man ritar upp det hela i en figur, dvs px pekar i x-riktningen. I verkligheten finns det ju ingen x-riktning.
Tack!
Hej igen! Jag har nu börjat undra en sak igen, som har att göra med min förra fråga.
En sista fråga om hybridisering, hur vet jag vilka av orbitalerna som hybridiseras och vilka som blir π-bindning vid sp- och sp^2 hybridisering? D.v.s. när jag får välja mellan 2px 2py och 2pz? Bör jag tänka på riktningen för de kovalenta bindningarna? Min första teckning stämmer överens med din 3d-bild av molekylen. Där hade jag antecknat 2px och 2py som π-bindningar (från min lärares genomgång), vilket stämde med din bild. Men hur ska jag tänka för andra molekyler?
Jag undrar hur antalet elektroner fördelas vid t.ex. sp^2-hybridisering av syre. Om vi säger att syrets orbitaler är 1s2 2s2 2px2 2py1 2pz1, hur kommer elektronerna fördelas sedan mellan de nya orbitalerna? De nya kallas ju sp^2 sp^2 sp^2 2px. Men hur fördelas elektronerna? Finns det någon bra generell regel man kan använda sig av för att bestämma detta? Du nämnde i ditt förra svar att skillnaden mellan px, py, pz egentligen inte har någon större betydelse då riktningarna bara är påhittade. Men i ett sådant här fall, hur vet man hur många elektroner som finns kvar i 2px efter sp^2-hybridisering av syre?
På samma sätt, hur ska man kunna räkna ut att vid sp^2-hybridisering av beryllium så kommer det gå från det här...
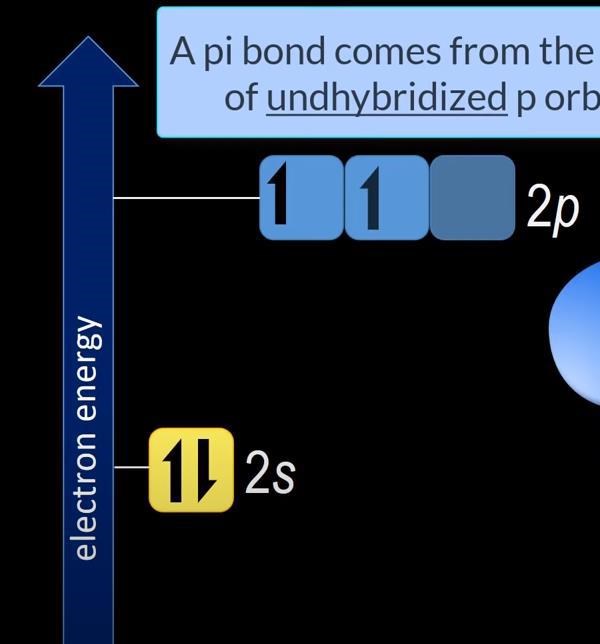
...till det här
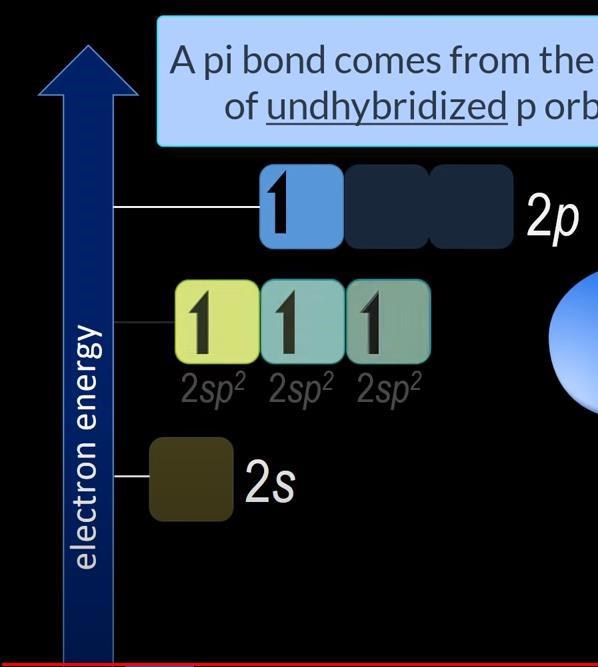
Varför kan inte den kvarstående 2p-orbitalen lika gärna vara tom på elektroner i stället? Då skulle en 2sp^2-orbital vara ett fritt elektronpar med 2 elektroner. Jag förstår inte varför det just måste vara som på bilderna.
Det har att göra med energiskillnaden mellan orbitalerna. En 2sp2-orbital ligger ganska nära en 2p-orbital i energi som du kan se i diagrammet medan en 2s-orbital har betydligt lägre energi än en 2p-orbital.
Det kostar energi att lägga elektroner i samma orbital eftersom de repellerar och skärmar varandra. Om det är en liten energiskillnad mellan orbitalerna blir det då mer fördelaktigt att lägga den elektronen i en egen orbital istället. Det kostar alltså mindre energi att lägga en elektron i 2p-orbital än att tvinga in den i en 2sp2-orbital där det redan finns en elektron.
Jämför man 2s och 2p är energiskillnaden större och då är det mer fördelaktigt att lägga två elektroner i 2s innan man börjar lägga elektroner i 2p.
Varifrån kommer de här bilderna? Jag vill läsa mer!
Smaragdalena skrev:Varifrån kommer de här bilderna? Jag vill läsa mer!
Mina senaste bilder kommer från https://www.youtube.com/watch?v=vHXViZTxLXo&t
En annan bra video är https://www.youtube.com/watch?v=wPw_LCmyjnI&t
Teraeagle skrev:Det har att göra med energiskillnaden mellan orbitalerna. En 2sp2-orbital ligger ganska nära en 2p-orbital i energi som du kan se i diagrammet medan en 2s-orbital har betydligt lägre energi än en 2p-orbital.
Det kostar energi att lägga elektroner i samma orbital eftersom de repellerar och skärmar varandra. Om det är en liten energiskillnad mellan orbitalerna blir det då mer fördelaktigt att lägga den elektronen i en egen orbital istället. Det kostar alltså mindre energi att lägga en elektron i 2p-orbital än att tvinga in den i en 2sp2-orbital där det redan finns en elektron.
Jämför man 2s och 2p är energiskillnaden större och då är det mer fördelaktigt att lägga två elektroner i 2s innan man börjar lägga elektroner i 2p.
Tack för ett bra svar!




