Organisk kemi - laboration - syntes av p-tert-butylfenol från fenol
VI ska göra en labb där början på beskrivningen är:
"Till en 50mL rundkolv adderas beräknad mängd tert-butylklorid och fenol tillsammans med en magnetloppa, och omrörning startas.
När fenolen gått in i lösningen tillsätts aluminiumtriklorid i en portion och reaktionsblandningen lämnas under omrörning.
När reaktionsblandningen stelnat tillsätts vatten (6mL) under omrörning. Tillsätt koncentrerad saltsyra om inte vattenfasen är sur (kontrollera med pH-papper)."
MINA (första) FRÅGOR:
1. Varför är detta en Sn1 reaktion och inte en E1?
2. Varför tillsätts även klorid i form av aluminiumtriklorid?
3. NÄR sker reaktionen egentligen? För jag trodde, enligt en video vi sett, detta var reaktionen
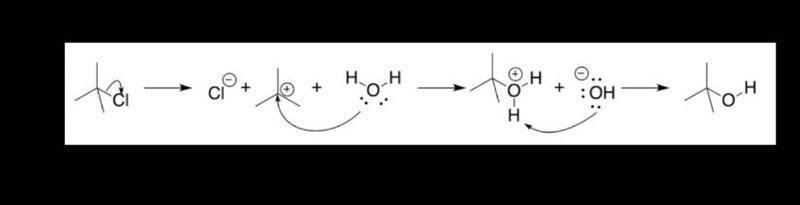
Så vi har kloret som lossnar av sig själv, sedan reagerar det med ... men vi har väl inget vatten här, eller? Så sker reaktionen först när vi tillsatt vattnet?
4. Men varför tillsätts syran - enligt reaktionen ovan så tar ju en BAS H:et från katjonen som reagerat med vatten och har ett H för mycket?
Verkligen förvirrad - eller kollar jag på helt fel reaktion (min bild ovan)?
Din bild visar en reaktion mellan p-tert-butylfenol och vatten. I din laboration skall p-tert-butylfenol reagerar med fenol. Det är ganska ovanligt att aromatiska föreningar reagerar genom elimination, eftersom de då förlorar möjligheten att uppnå resonans.
Smaragdalena skrev :Din bild visar en reaktion mellan p-tert-butylfenol och vatten. I din laboration skall p-tert-butylfenol reagerar med fenol. Det är ganska ovanligt att aromatiska föreningar reagerar genom elimination, eftersom de då förlorar möjligheten att uppnå resonans.
Min bild visar väl tert-butylklorid? Hur som - tänkte inte på fenol att det är en ring utan tänkte bara alkohol - OH - ... Glöm bilden.
Men jag förstår fortfarande inte vad vi gör och vad som häder - vi ska skriva upp mekanismen för reaktionen men hur sker den och vilka substanser ingår?
Vi har fenolringen och tert-butylklorid. Hur kan fenol gå in i/lösas i kloriden? Kloriden är väl inte polär?
Och varför tillsätts AlCl3?
Varför stelnar detta?
Vad gör vattnet
och syran?
Vet itne vart jag ska börja...
Varför skulle inte en aromatisk ring kunna eliminiera? Det beror väl på hur kvarvarande del ser ut - om p/pi-elektroner kan "flyta runt" mellan p-orbitaler?
Mekanismen bör vara densamma, fast byt ut H2O mot C6H5OH. Syret fungerar på samma sätt fast produkten man får blir väl tert-butylfenyleter eller vad det nu bör kallas. Jag vet inte riktigt hur du får det till en elimination eftersom det inte direkt finns något som elimineras.
Min magkänsla är att AlCl3 fungerar som katalysator för att "lura ut" kloratomen och bilda komplexet .
Reaktionen sker i flera steg och man kan inte säga att den enbart sker i ett visst ögonblick. Alla steg i mekanismen är nödvändiga, men självklart kan du inte bilda produkten utan att ha alla reaktanter i lösningen.
Varför jag undrade om allt ingick o reaktionen var för jag tänkte ngt ämne kanske var för senare steg i linsen.
med elimination tänkte jag att kloret på Gert-butylklorid skulle lossna som på min bild.
men hur går fenol in i tert-butylkloriden? Den kan väl inte lösa sig i den?
Men du skriver att det skall bildas p-tertbutyl-fenol - då skall tertbutylgruppen sitta på ringen mitt emot OH-gruppen. Dp skall den int ealls reagera med syreatomen.
Smaragdalena skrev :Men du skriver att det skall bildas p-tertbutyl-fenol - då skall tertbutylgruppen sitta på ringen mitt emot OH-gruppen. Dp skall den int ealls reagera med syreatomen.
 Hoppas det går att se-längst upp i rutan: ser min mekanism ut som den kan stämma?
Hoppas det går att se-längst upp i rutan: ser min mekanism ut som den kan stämma?
Sen tänker jag att allt reagerar 1:1:1 så om man kollar i min tabell är det minst av fenolen vi får (mängderna i gram som är skrivet på dator är vad vi får jobba med) - Mao ska vi ha antalet mol av fenol av de andra också. Rätt?
Givetvis finns Friedel-Craftsalkylering på Wikipedia. Det ser ut som om ni är överens om mekanismen.
Ni skall tydligen ha överskott av tert-BuCl.
Tack!
Varför ska vi ha överskott?/hur vet du det?
vi har mängderna i tabellen men det står också längst upp på pappret " beräkna de mängder som ska användas"
Du skall räkna ut hur många mol du har av varje reaktant, så att du kan jämföra mängderna med varandra och veta vad som är begränsande (och du behöver veta det om du skall kunna beräkna utbytet).
Okej, eftersom jag ser att du har gjorrt ett seriöst försök, och ställer flera riktigt bra frågor, kommer här ett försök att reda ut det hela lite mer fullständigt -- och förhoppningsvis stilla en del av din förvirring!
gulfi52 skrev:
* * *
Precis som du har skrivit kan man tänka sig att reaktionen sker i två steg.
Steg 1: En kraftigt elektrofil karbokatjon bildas genom att tert-butylkloriden faller sönder med hjälp av AlCl3. Från kapitlet om SN1-reaktioner vet du säkert att tert-butylklorid egentligen kan bilda en karbokatjon utan hjälp av AlCl3:

Men detta är en jämviktsreaktion som är starkt förskjuten åt vänster. Positivt laddade kolatomer (dvs. karbokatjoner) är ju som du vet väldigt instabila, så detta är ingen gynnsam reaktion alls. Detta innebär att det i varje ögonblick bara kan finnas väldigt låga koncentrationer av karbokatjoner i reaktionsblandningen.
Vid SN1 reaktioner har man ofta rätt starka nukleofiler som t.ex. vatten, hydroxidjoner eller halidjoner, så det gör inte så mycket om koncentrationen av karbokatjoner blir låg. Reaktionen går tillräckligt snabbt ändå.
Men när man i stället har en svagare nukleofil (bensenringen i fenol är ett exempel på detta!) gäller inte detta. Då måste man ha så hög elektrofilkoncentration som möjligt, och då duger inte de låga koncentrationerna som jämvikten ovan skulle leda till.
Det är just på grund av detta man behöver AlCl3. AlCl3 väldigt elektronhungrigt (den har ett tomt p-orbital om du vet vad det betyder; ett annat sätt att se att den är kraftigt elektrofil är att den inte uppfyller oktettregeln, så den har plats att ta emot ett elektropar från klor). Så AlCl3 kommer gladeligen ta upp de negatit laddade kloridjonerna på följande sätt:

Därmed förskjuts jämvikten i steg 1 åt höger (tänk på Le Chateliers princip!), så att koncentrationen av karbokatjonen går upp.
Steg 2: Den elektrofila karbokatjonen reagerar med den nukleofila fenolen. Som vid alla andra Friedel-Crafts-reaktioner bildas en väldigt instabil intermediär (den är instabil eftersom aromatisiteten hos bensenringen har blivit bruten, men stabiliserar lyckligtvis lite av att plusladdningen sprids ut över molekylen genom så kallad resonans, där även syret i OH-gruppen deltar). Rita gärna ut resonansformerna! Intermediären redan reagerar vidare till den önskade produkten genom att en vätejon lossnar.
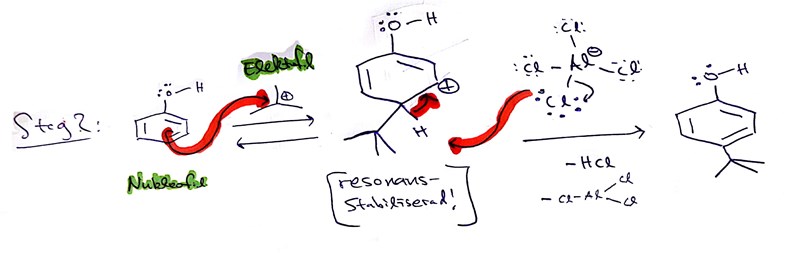
För att vätejonen ska lossna krävs något negativt laddat -- en bas. Och den enda basen vi har närvarande är de där kloridjonerna som bildades i steg 1, som nu gör en come back i reaktionen! Kloridjonen lämnar något motvilligt det elektronhungriga aluminiumet och atackerar vätet, och gasformig HCl lämnar då lösningen. Det är väldigt gynnsamt när gasformiga produkter bildas vi en reaktion (på grund av att gaser har hög oordning/entropi, i fall ni har läst om det i allmän kemi), vilket förklarar att kloridjonen kan tänka sig att lämna det elektronhungriga aluminiumet.
Som du ser återbildas AlCl3 i detta sista steg, och man skulle alltså kunna säga att AlCl3 har fungerat som en katalysator. Den hjälpte reaktionen att ske genom att hjälpa till vid bildandet av karbokatjonen, men förbrukas inte. Som vi dock strax ska se är detta en sanning med modifikation.
* * *
Vi har nu rett ut huvuddelen av reaktionen, som alltså består av två steg: (1) karbokatjonen bildas (2) karbokatjonen reagerar med fenolen via en reaktiv intermediär.
Lägg märke till att alla reaktionssteg egentligen är ganska lika varandra. Det är alltid elektronrika nukleofiler som reagerar med elektronhungriga elektrofiler. Lägg också märke till att AlCl3 påminner väldigt mycket om karbokatjonen. Båda är plana strukturer med en centralatom som har plats för ett extra elektronpar (har en tom p-orbital).
* * *
Nu måste vi prata om ett par klurigheter och komplikationer vid reaktionen, som du kanske märkte av under själva labben.
Prioblem 1. Det kan ske ett antal olika sidoreaktioner. Dels kan man tänka sig att man får så kallad orto- eller meta-substitution i stället för para-substitution. Till viss del får man säkert det, men jag skulle personligen gissa att para-substitutionen är den reaktion som går absolut snabbast och därför dominerar. Har du några idéer om varför? En bra övning vore att rita ut mekanismerna för orto- och meta-substitutionerna, och jämföra med denna.
(Om man vill vara riktigt petig: Det finns även en tänkbar E1-reaktion som skulle kunna ställa till det här. Förstår du vilken reaktion jag menar? Vad talar för eller mot den?)
Problem 2. Det elektronhunrgia aluminiumet i AlCl3 kommer att ha en tendes att sätta sig på dels syret i fenolen och dels syret i produkten, eftersom syret är en bra nukleofil. Det går till så här:
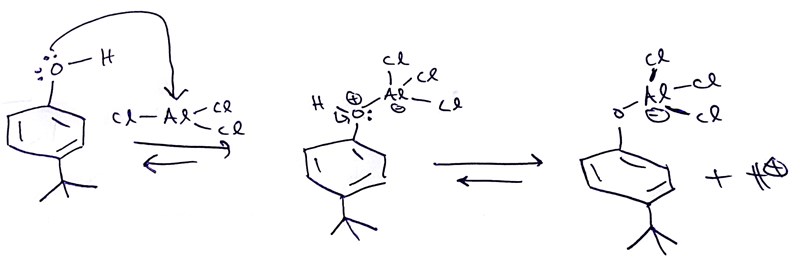
I stället för att göra sitt jobb och hjälpa till vid bildandet av karbokatjonen, så kommer alltså en del av AlCl3-molekylerna vara upptagna med att gosa med OH-gruppen. Detta är en av anledningarna till att vi behöver ett överskott av AlCl3, trots att AlCl3 bara är en katalystor.
För att i slutändan få fram ren produkt behöver vi koppla bort de där klängiga AlCl3-molekylerna, vilket vi gör genom att tillsätta något som de tycker är minst lika nukleofilt (och som AlCl3 tycker är minst lika gosigt) som OH-grupper: vatten. Genom att tillsätta en stor mängd vatten blir vi av med aluminiumkloriden som reagerar och bildar AlCl3OH(-):
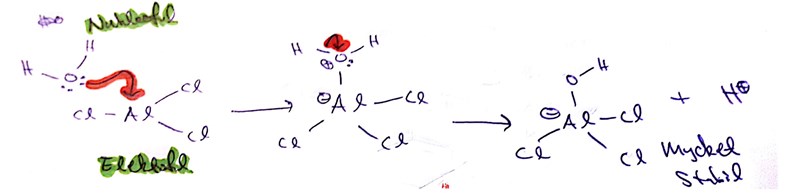
Vattnet hjälper även till att separera produkten (som är ganska svårlöslig i vatten, men som gärna löser sig i organiska lösningsmedel) från AlCl3OH(-) och rester av väteklorid som vi inte vill få in i våra kristaller.
Problem 3. Produkten har dock en liten tendens att lösa sig i vatten, vilket sker genom att den fungerar som en svag syra i vatten:
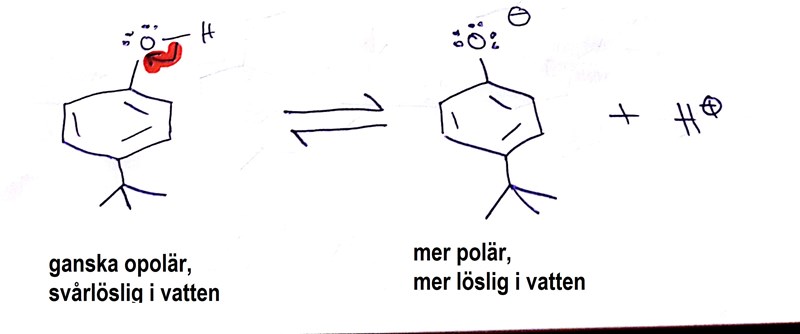
Den korresponerande basen är lite mer polär, och tenderar därför att lösa sig i vattenfasen vid extraktionen. För att undvika att vi blir av produkt på det här viset ser man till så att vattenfasen är ordentligt sur, så att jämvikten (återigen enligt Le Chateliers princip!) är rejält förskjuten åt vänster.
Problem 4. Fenol har ungefär samma löslighetsegenskaper som para-tert-butylfenol (i och med att de har liknande struktur). Det innebär att om en del av fenolen inte reagerar så kommer det vara svårt att separera överbliven fenol från produkten (båda kommer exv. hamna i organfasen om du gör en extraktion). Du riskerar att få en oren och potentiellt oanvändbar produkt!
Om vi får överbliven tert-butylklorid å andra sidan kommer det inte vara ett problem. Den kommer reagera med vattnet (hur?) och i slutändan hamna i vattenfasen.
Av dessa skäl är det smart att ha ett litet överskott av tert-butylklorid vid reaktionen, så att all fenol verkligen reagerar -- och det är ju precis vad du verkar ha haft här :)
* * *
Okej, det här blev ett väldigt lång inlägg. Hoppas något blev klarare. Annars är det bara att fråga mer, så hjälper jag eller någon annan dig gärna ytterligare :)
Tack så jättemycket för du tog dig tiden till att förklara så ingående! - återkommer nog med någon fråga för att verkligen förstå men det hjälpte mycket!





