pH i en salmiak lösning när kB är 1.8x10^-5
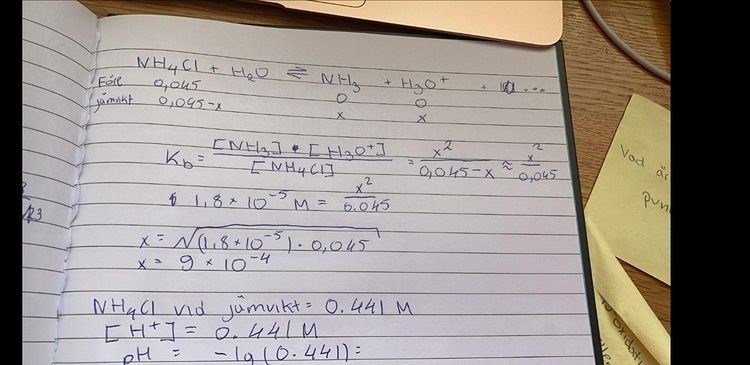 Hej! Det här är själva uppgiften:
Hej! Det här är själva uppgiften:
Beräkna pH i en 0,045 mol/dm3 lösning av salmiak (NH4Cl). Kb för ammoniak (NH3) är
1,8*10-5 mol/dm3. pKW=14,00.
Så här gör jag själv men jag känner att jag gör fel och blir bara mer förvirrad, någon som kan hjälpa mig?
Välkommen till Pluggakuten!
Du har fel definition för Kb - det bildas inte oxoniumjoner när ammoniak protolyseras. (Dessutom skall det vara ammoniumjoner, inte ammoniumklorid).
Smaragdalena skrev:Välkommen till Pluggakuten!
Du har fel definition för Kb - det bildas inte oxoniumjoner när ammoniak protolyseras. (Dessutom skall det vara ammoniumjoner, inte ammoniumklorid).
Ser formel ut då så? : NH3 + H2O (jämvikt pilar) NH4 + + OH-? Hur menar du med Kb? Känns som jag blir bara mer och mer förvirrad
Läs om baskonstanten här. Återkom om du har fler frågor!


