pH, pKa, buffertlösning - halvtitreringspunkt?
Hej , jag undrar över två saker. Först undrar jag över om jag har gjort rätt på fråga 1, 2a) och 2b). Sen behöver jag hjälp med 2c). Jag har börjat lite, men vet inte hur jag ska fortsätta .
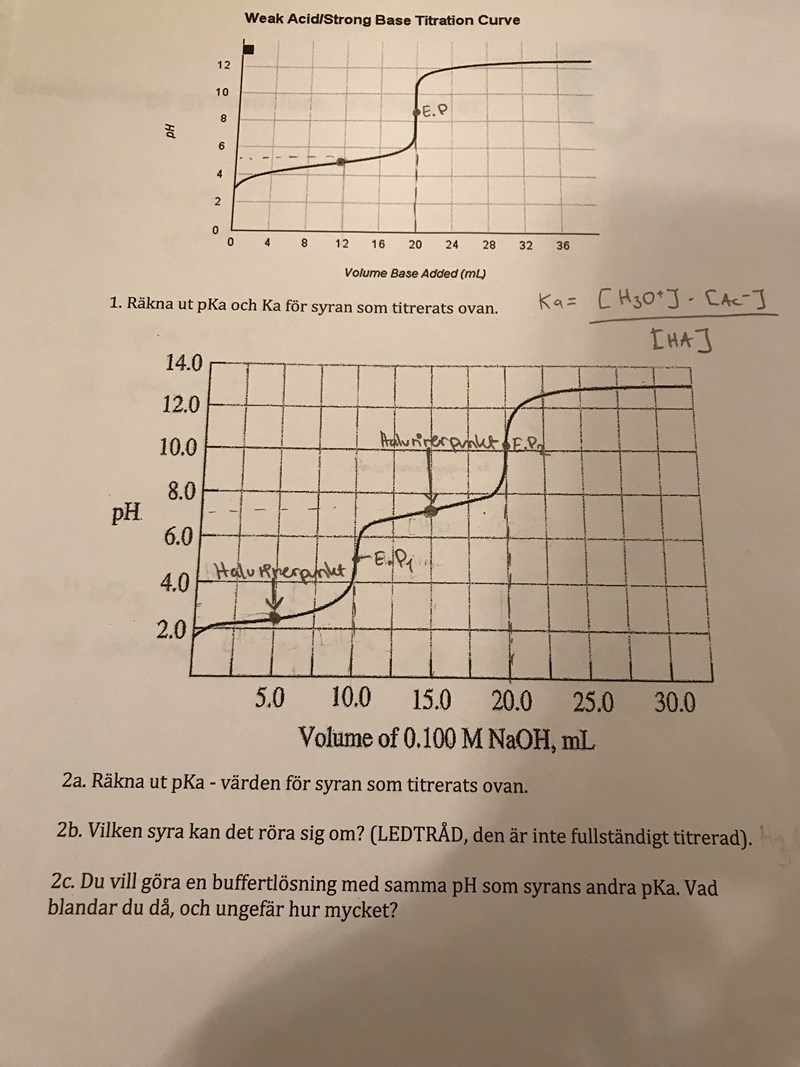

Den första är fel. Hälften av 20 är inte12.
2a verkar stämma båda två. Håller med om att det är fosforsyra.
Vid punkten pH = pKa2, vad är det då man har blandat, och i vilka proportioner? Du har en bra buffert där! (Det finns flera möjligheter att blanda olika ämnen för att få precis den sammansättning du har där, men det räcker med den varianten du har använt här.)
Skyller på slarvfel
Är det då H2PO4- och HPO42- ? Vad menar du med i vilka proportioner?
En möjligthet att tillverka den önskade bufferten är att blanda t ex med , lika mycket av varje. En annan är att göra som vid titreringen - att blanda a mol fosforsyra med 1,5a mol NaOH. När man har gjort de här båda buffertarna kan man inte veta vilken som är vilken av dem (om koncentrationerna är lika), de är helt identiska.
Okej, bara en fråga. Varför Na2NPO4 och inte Na2HPO4. Om man använder sig av den bufferten ska det vara lika mycket NaH2PO4 som Na2NPO4. Men när man använder sig av den andra buffertvarianten då förhåller de sig som 1 : 1,5. Varför är det så?
Om du blandar 1 mol fosforsyra med 1,5 mol NaOH så kommer 1 mol NaOH att reagera med fosforsyran, så att det bildas 1 mol divätefosfatjoner. Hälften av dessa divätefosfatjonerna kommer att reagera med den sista halva molen natriumhydroxid så att det bildas vätefosfatjoner. Hälften vätefosfatjoner och hälften divätefosfatjoner - precis vad vi ville ha.
Aha okej, då förstår jag. Tack :)
detrr skrev :Okej, bara en fråga. Varför Na2NPO4 och inte Na2HPO4. Om man använder sig av den bufferten ska det vara lika mycket NaH2PO4 som Na2NPO4. Men när man använder sig av den andra buffertvarianten då förhåller de sig som 1 : 1,5. Varför är det så?
Observera att Na2NPO4 var ett skrivfel av Smaragdalena. N sitter intill H på tangentbordet.
Ja, jag märkte det sen glömde kanske ändra mitt inlägg. Tack för påpekandet!
Om du bara visste hur många "sulfat" jag fick ändra till "fosfat" innan jag skickade imitt förra inlägg... Hoppas jag inte missade något!




