PH vid titrering
Hej ska lösa denna uppgift;
25 ml HClO2 [0,01] titreras med 17,5 ml NaOH [15*10^-3]. Beräkna pH.
Då det är en svag syra ställde jag upp följande tabell
HA <=> H+ + Ac-
Före 5,823...*10^-3M 0 2,941...*10^-3M
Diff. -x +x +x
Löste utifrån detta ut x=0,00406...=[H+]
pH=-log[H+]=2,3916...
pH ska uppenbarligen vara >7 då det är ett överskott på NaOH.
Skulle verkligen verkligen behöva hjälp! Stort tack om du lyckas lösa denna!
Vänliga hälsningar,
Domenique.
Hur har du räknat fram dina koncentrationer? De ser konstiga ut.
Du har alltså blandat 0,00025 mol syra och 0,0002625 molbas. Det är mer bas än det är syra , så all syra är förbrukad och man har dessutom tillsatt 0,0000125 mol hydroxidjoner. Det ä rsamma situation som om du har blandat 0,00025 mol av syrans natriumsalt med 0,0000125 mol NaOH.
Du behöver använda dig av Kb, inte Ka, i denna beräkning för en övertitrerad lösning.
Du kan väl generellt använda dig av både Ka och Kb vid lösning av denna typ av uppgifter.
Bara att du får utgå ifrån antingen
HA <=> Ac- + H+
eller
A- + H2O <=> HA + OH-
I detta fall använde jag Ka för HClO2. Har ej funnit Kb för NaOH om det finns. Den första koncentrationen är n(NaOH)-n(HClO2)/tot V. Den andra är n(HClO2)/Vtot.
Bifogar mina uträkningar hoppas de går att läsa. Skulle vara så tacksam för hjälp!
Du har (nästan) ingen HA i din lösning, eftersom du har tillsatt så mycket hydroxidjoner.
Reaktionen du skall använda dig av är när kolritjonen reagerar med vatten så att det bildas klorsyrlighet och hydroxidjoner. Därför är det Kb du skall använda dig av, inte Ka. Eftersom du använder dig av fel formel är det inte konstigt att du får fel svar. Det du har räknat ut är vilket pH du får om du har 0,00025 mol klorsyrlighet och 0,0000125 mol hydroxidjoner i 42,5 ml vatten (inte konstigt att det är surt och inte basiskt!).
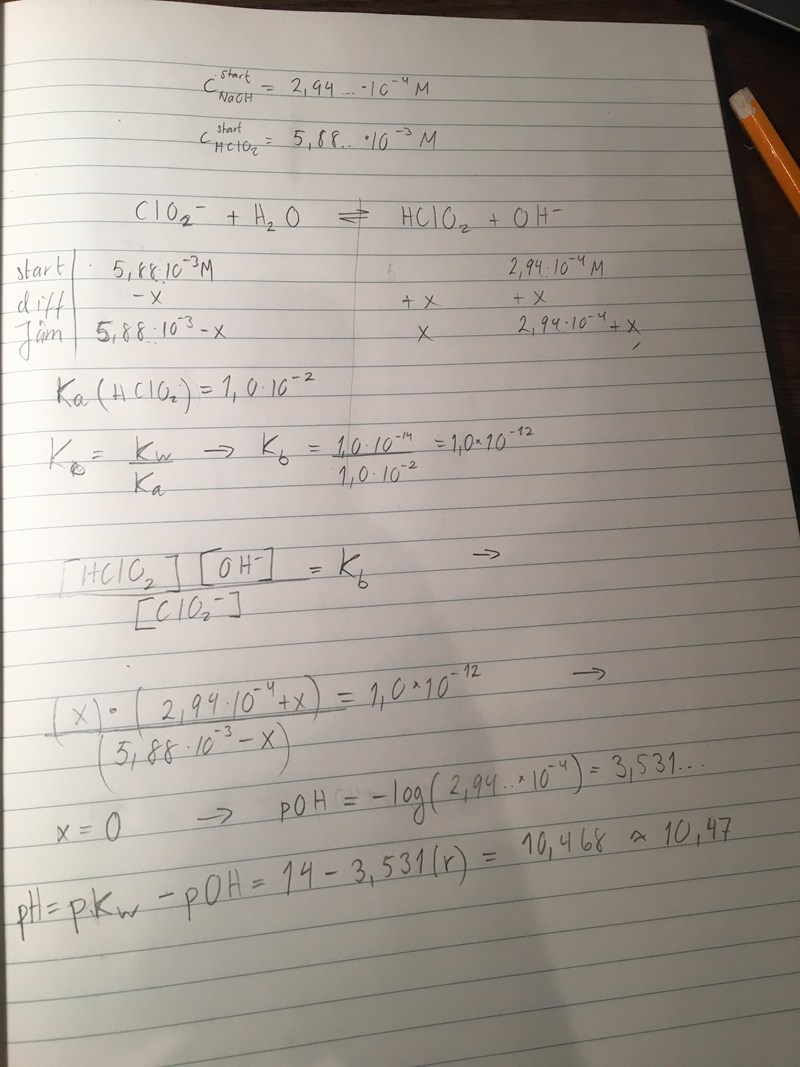 Löste nu enligt följande. Verkar det bra?
Löste nu enligt följande. Verkar det bra?
Måste jag ställa upp enligt
A- + H2O <=>HA +OH- då det är ett överskott av OH- (bas).
&
HA<=>H+ + A- då det är ett överskott av H+?
Tack!!
Måste och måste... Det är i alla fall vad jag skulle göra.
Okej stort tack blir det rätt med startkoncentrationerna?
Eftersom du bara har slängt fram siffrorna utan några uträkningar klarar jag inte att kolla på det så här dags, det skulle vara för stor risk att det blir fel. Jämt över är uträkningarna och formlerna mycket mer intressanta än svarssiffrorna.


