Redoxbalanseing- halvcellsmetod
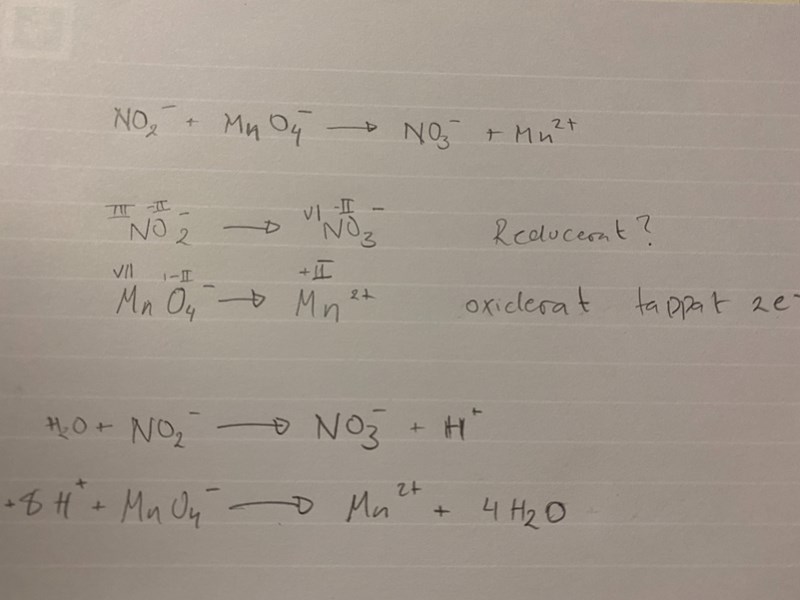
Jag har en fråga angående min balansering? Jag vet inte hur jag ska tänka när jag ska balansera laddningarna med e⁻ ? En annan fråga som har är om NO2⁻ som blir till NO3⁻ , blir det en reduktion? jag tänker att laddningen är densamma så vet ej om den reduceras eller inte.
Jag tycker det är enklare att tänka på oxidationstal. Vilket oxidationstal har kväveatomen i nitritjonen? Vilket oxidationstal har kväveatomen i nitratjonen? Ett stegs oxidationstalsändring motsvarar en elektron.
Kväve i nitritjonen har OT: + III
Kväve i nitratjonen har OT: +VI
alltså har OT ökat och det blir en oxidation?
Och Permangantjonen har reducerat?
Mangan i permanganat har reducerats till mangan(II)jon. Permanganatjonen är ett oxidatinsmedel, d v s det får något annat att oxideras.


