Sammanfattning för kemiska beräkningar, Kemi 1
Hej
Jag har gjort en grundläggande sammanfattning samt uppgifter på tre olika nivåer över området "kemiska beräkning" inom kemi 1 kursen på gymnasiet. Tanken med detta inlägg är att få feedback från både användare, men också speciellt ni som är aktiva i kemi forumet samt admins om detta är något som skulle behövas mer av i andra delar. Skriva gärna era åsikter i tråden eller skicka ett PM till mig så vet jag.
OBS! detta är en övergripande sammanfattning kan finnas stavfel etc i texten, men ska åtgärda det så fort jag kan.
Tråden klistrad av Teraeagle.
Substansmängd
I kemins värld räcker de inte med berätta om hur stor massa nåt har. Olika ämnens massor är olika, detta gör om vi har 1 g av ett ämne och 1 g av något att kan de ha olika många molekyler eller atomer som dom består av. Detta gör att vi måste inför begreppet substansmängd för att se till exempel hur många molekyler man har.
Enheten för substansmängd är mol. Där en mol är ett exakt antal som t.ex. ett par skor, ett dussin skor eller en mol skor. 1 mol motsvarar ungefär st av någonting.
För ni som vill veta lite mer vart talet kommer ifrån har de med att göra av definitionen av substansmängd där de är antalet atomer som finns i ett prov av 12 g kol-12.
Hur massa, molmassa och substansmängd hänger ihop
Den första sambandet som ni kemister kommer i kontakt med i kemi 1 är:
- Massan har beteckningen m och har enheten g (gram).
- Molmassan har beteckningen M och enheten g/mol (gram per mol)
- Substansmängd har beteckningen n och enheten mol (mol)
För att demonterar hur man använder sig av formeln har jag valt tre olika exempel på tre olika nivåer. Jag rekommenderar att ni läser frågan och försöker lösa uppgiften själv innan ni kollar på lösningen.
Uppgifter:
Nivå 1: Beräkna substansmängden för 50 g natrium.
Lösning: Givet: Molmassa för natrium: 23 g/mol, Massa natrium: 50 g
Svar: 2,2 mol
Nivå 2: Beräkna a) mängden (i mol) samt b) massan (i gram) av det vatten som finns i 2,5 mol .
Lösning:
Vi har 2,5 mol kristalliserad kopparsulfat, dvs
a) Enligt formeln finns det 5 vattenmolekyler för varje -molekyl. Det innebär att 2,5 mol innehåller vatten.
b) Molmassan för vatten , vilket gör att massan för vattnet är:
Svar: a) 12,5 mol b) 230 g
Nivå 3: För att bestämma atommassan för kadmium, Cd, gör man följande försök: 1,5276 g kadmiumklorid, , elektrolyseras så att man får metalliskt kadmium, Cd, och kadmiumfria produkter. Det metalliska kadmiumet har massan 0,9367 g. Klors atommassa antas vara 35,453 u. Hur stor blir kadmiums atommassa enligt detta försök?
Lösning: Vi börjar med att bestämma hur stor substansmängd klor som fanns i kadmiumkloriden.
,
En innehåller två klor vilket medför att substansmängden:
Svar: 112,40 u
Skriva reaktionsformel
När vi skriver en reaktionsformel är det viktigt att ha koll på begreppen
⦁ Reaktanterna
⦁ Produkterna
Reaktanterna står vänster om reaktionspilen och produkterna står höger om reaktionspilen.
T.ex. reaktant + reaktant produkt + produkt
Lagen om massans oförstörbarhet i en kemisk reaktion
⦁ Vid en kemisk reaktion är massan konstant
⦁ Produkternas sammanlagda massa är den samma som reaktanternas sammanlagda massa
⦁ Produkter består av reaktanternas atomer. Atomer varken bildas eller försvinner i en kemisk reaktion.
Lagen om de konstanta proportionerna:
⦁ Det är alltid ett bestämt förhållande mellan massorna av de ämnen som bildar en kemisk förening.
Hur använder vi oss av reaktionsformeln
Reaktionsformeln talar om en viktigt sak och det är förhållandet mellan substansmängderna:
Ex: , vilket vi kan skriva som:
Kemisterna pratar oftast om ekvivalenta mängder: Det antal mol som svarar mot varandra i en reaktion. Vi går tillbaka till exemplet ovan:
Istället för att skriva förhållandet 2 : 1 : 2 kan vi skriva följande:
Uppgifter:
Nivå 1: En trevlig reaktion där natriumhydroxid bildas. . Bestäm förhållandet mellan substansmängderna.
Lösning:
Vi kollar på koefficienterna framför respektive ämne vilket gör att förhållandet är:
Beräkning med hjälp av molförhållandent
En metod som används för att lösa problem är följande 6 punkterna
1: Börja med att skriva reaktionsformler
2: Gör en tabell eller givet ruta vad vi vet av , och för varje ämne
3: Beräkna utifrån det som går att beräkna med hjälp av sambandet
4: Vad för molförhållandet mellan den du vet jämför den du vill veta?
5: Beräkna substansmängd för de ämnen du vill ta fram.
6: Beräkna slutligen om du vill t.ex. få veta massan av ett ämnen kan vi ta hjälp av formeln
Vi tar självklart ett exempel här med:
Uppgifter:
Nivå 1: Koppar reagerar med varm, utspädd salpetersyra enligt formeln . Hur stor mängd (i mol) kvävemonoxid bildas då 0,15 mol koppar reagerar med överskott av salpetersyra?
Lösning: Givet: . Vi söker . Vi ställer upp mängdförhållandet mellan okänt ämne och känt ämne. Enligt reaktionsformeln:
Svar: 0,10 mol
Empirisk formel vs. molekylformel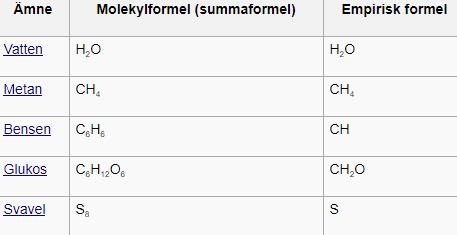
Utbytesbestämmande ämnen
Det ämne som tar slut först i en kemisk reaktion är utbytes bestämmande. Övriga ämnen är i överflöd. Detta gör att vi måste ta hänsyn till hur mycket av ett ämne vi kan få beroende på hur mycket vi har av respektive reaktant. För att gör de tydligare tar vi ett härligt exempel.
Uppgifter:
Nivå 1:
Nivå 2: En laborant blandar 45 g triklormetan och 15 g brom för att framställa bromtriklormetan enligt formeln: . Vilken är den största massa av bromtriklormetan som kan bildas?
Lösning: Reaktionsformeln visar att 1,0 mol triklormetan och 1,0 mol brom ger 1,0 mol bromtriklormetan. Den av reaktanterna, som ingår med minst substansmängd i reaktionen, kommer att bestämma det maximala utbytet av bromtriklormetan.
Molmassor:
, ,
Substansmängder:
Brom ingår således med minst substansmängd, 0,094 mol. Om man förutsätter 100% utbyte får man 0,094 mol bromtriklormetan, vilket motsvarar massan
Svar: 19 g
Nivå 3:
Koncentration
Koncentration = Substansmängd/Volym
- Substansmängd har beteckningen n och enheten mol (mol)
- Volym har beteckningen V och har enheten (kubikdecimeter eller liter ).
- Koncentration har beteckningen C och enheten (mol per kubikdecimeter). Kan även uttryckas med enheten M (molar).
Sambandet som gäller är följande: . Om vi skriver om den lite kan vi även få följande samband:
Uppgifter:
Nivå 1: Hur stor volym natriumhydroxidlösning med koncentrationen behövs för att bereda natriumhydroxidlösning med koncentrationen ?
Lösning: , Natriumhydroxidlösningen med koncentrationen innehåller lika stor mängd .
Svar:
Nivå 2: För att få tillgång till 0,20 M lösning av saltsyra kan man blanda vatten med 2,50 M saltsyralösning. Hur stor volym skall man ta av den 2,50-molara lösningen?
Lösning: . Den tillförda 2,50-molara lösningen måste innehålla lika stor mängd saltsyra.
Svar:
Nivå 3: Hur stor blir natriumjonkoncentrationen om man blandar 65,5 ml av en 0,15 M sodalösning med 30,0 ml av en vanlig koksaltlösning som har koncentrationen 0,350 M? Soda är detsamma som natriumkarbonat.
Lösning: Vi beräknar substansmängderna i de båda lösningarna. Soda är natriumkarbonat. Lösning 1:
,
I varje formelenhet finns det två natriumjoner. Således:
Lösning 2:
I varje formelenhet finns en natriumjon, det innebär att:
Totala koncentrationen natriumjoner i blandningen av lösningarna blir:
Svar:
Masshalt och massprocent
- Masshalt = massa/volym t.ex.
- Massprocent = ämnets massa i procent av lösningens totala massa. SI-enheter och ,
Ofta får man inte 100% av den produkt reaktionsformeln föreskriver. Man kanske får 90%, vilket gör att utbytet endast är 90%. Om du teoretiskt skulle få 80g av en produkt, men bara får 56g, då är utbytet . Utbytet för reaktionen är alltså 70%.
Aggregationstillstånd
Att sätta ut beteckningar för aggregationstillstånd i en reaktion viktigt. Om inget annat anges så är det ämnets aggregationstillstånd under normal temperatur och tryck.
Beteckningarna är: (g) gas, (l) flytande, (s) fast och (aq) vattenlösning.
Om jag skriver då är vattnet i gasform dvs vattenånga, då är vattnet i flytande form, då är vattnet i fast form dvs is. då är saltet upplöst i en vattenlösning.
Förmågan att kunna analysera i kemin
Det två grundstenarna i kemin är:
⦁ Kvalitativ analys
⦁ Kvantitativ analys
Vad är av största vikt vid kemisk analys? Jo, att varje steg måste utföras med samma noggrannhet.
Några analysmetoder som använd under dom två momenten är:
⦁ Lågfärg
⦁ Fällning
⦁ (Spektrofotometri)
(OBS! In snar framtid ska jag uppdatera med en uppgift visar de båda momenten i en utförlig uppgift.)
Absorbans och Lambert-Beers lag
Uppgifter är på väg kommer in snar framtid!
Skriven av, Jonathan Korhonen Lundberg (Jonis10)
Fint och mycket hjälpsamt. Men något om PH?
har du inte sammanfattning för syra baser, kemi 1 också?



