Syror och baser
Jag har fastnat med uppgiften.
b) Vad händer om du häller syran respektive basen i ett glas vatten? Motivera genom att skriva reaktionsformler och förklara med kemiska begrepp. OBS! Du ska använda den syra och bas som du hittat i ditt hem.
I ditt svar ska följande begrepp finnas med: protolys, protontagare, protongivare, proton, syra, bas
c) Vad händer om du häller lösningar av syran och basen i ett nytt glas och blandar om? Motivera genom att skriva en balanserad formel. Vad kallas denna reaktion?
Min förslag:
b) citron och NaOH
En syra är en protongivare. I vattenlösningen händer protolys då varje cintronsyra molekyl har avgett en proton, som tas upp av en vattenmolekyl som är protontagare.
C₆H₈O₇ (l) + 3H2O (l) → C6H5O7- + 3H3O+ (aq)
En bas är en protontagare. Det sker ingen protolys. Hydroxidjonerna finns redan i NaOH.
NaOH (s) + H2O (l) → Na+ (aq) + OH- (aq)
Är det rätt förklaringen och formel?
c) Det måste hända neutralisering tycker jag.
C₆H₈O₇ (aq) + 3NaOH (aq) → Na3C6H5O7(aq) + 3 H2O(l)
Stämmer?
Tack!
AAnastasiia skrev:Jag har fastnat med uppgiften.
b) Vad händer om du häller syran respektive basen i ett glas vatten? Motivera genom att skriva reaktionsformler och förklara med kemiska begrepp. OBS! Du ska använda den syra och bas som du hittat i ditt hem.
I ditt svar ska följande begrepp finnas med: protolys, protontagare, protongivare, proton, syra, bas
c) Vad händer om du häller lösningar av syran och basen i ett nytt glas och blandar om? Motivera genom att skriva en balanserad formel. Vad kallas denna reaktion?
Min förslag:b) citron och NaOH
En syra är en protongivare. I vattenlösningen händer protolys då varje cintronsyra molekyl har avgett en proton, som tas upp av en vattenmolekyl som är protontagare.
C₆H₈O₇ (l) + 3H2O (l) → C6H5O7- + 3H3O+ (aq)
Nej inte riktigt. För syran är det tre protoylssteg med varsin jämvikt.
Och protolysen sker inte helt för citronsyran d.v.s. alla tre karboxylsyragrupper kommer inte protolyseras. Citronsaft har ett pH ca 2, så i saften är det endast en karboxylsyragrupp per molekyl som börjat protolyseras, så de andra två är fortfarande i syraform. När du späder citronsaften och citronsyran i vatten förskjuts detta och mer syra protolyseras. Men så snart protolysen sker kommer pH i vattnet sjunka och till slut uppstår en ny jämvikt - där citronsyran deltar som både syra och bas.
Skulle du istället ha det finnas en bas närvarande, som kan ta emot den första protonen, förskjuts jämvikten hela tiden åt höger och protolyseringen kommer fortsätta med den andra karboxylsyragruppen och tillslut den tredje och sista (om det finns tillräckligt mycket av basen).
En bas är en protontagare. Det sker ingen protolys. Hydroxidjonerna finns redan i NaOH.
NaOH (s) + H2O (l) → Na+ (aq) + OH- (aq)
Stämmer.
c) Det måste hända neutralisering tycker jag.C₆H₈O₇ (aq) + 3NaOH (aq) → Na3C6H5O7(aq) + 3 H2O(l)
Stämmer?
Ja det sker en neutralisation. Men det är flera jämvikter (så tänk på pilen tillbaka).
Och eftersom din citronsyra har tre karboxylsyragrupper blir det tre jämvikter, som genom basen förskjuts mot den helt protolyserade formen C6H5O73- .
mag1 skrev:AAnastasiia skrev:Jag har fastnat med uppgiften.
b) Vad händer om du häller syran respektive basen i ett glas vatten? Motivera genom att skriva reaktionsformler och förklara med kemiska begrepp. OBS! Du ska använda den syra och bas som du hittat i ditt hem.
I ditt svar ska följande begrepp finnas med: protolys, protontagare, protongivare, proton, syra, bas
c) Vad händer om du häller lösningar av syran och basen i ett nytt glas och blandar om? Motivera genom att skriva en balanserad formel. Vad kallas denna reaktion?
Min förslag:b) citron och NaOH
En syra är en protongivare. I vattenlösningen händer protolys då varje cintronsyra molekyl har avgett en proton, som tas upp av en vattenmolekyl som är protontagare.
C₆H₈O₇ (l) + 3H2O (l) → C6H5O7- + 3H3O+ (aq)
Nej inte riktigt. För syran är det tre protoylssteg med varsin jämvikt.
Och protolysen sker inte helt för citronsyran d.v.s. alla tre karboxylsyragrupper kommer inte protolyseras. Citronsaft har ett pH ca 2, så i saften är det endast en karboxylsyragrupp per molekyl som börjat protolyseras, så de andra två är fortfarande i syraform. När du späder citronsaften och citronsyran i vatten förskjuts detta och mer syra protolyseras. Men så snart protolysen sker kommer pH i vattnet sjunka och till slut uppstår en ny jämvikt - där citronsyran deltar som både syra och bas.
Skulle du istället ha det finnas en bas närvarande, som kan ta emot den första protonen, förskjuts jämvikten hela tiden åt höger och protolyseringen kommer fortsätta med den andra karboxylsyragruppen och tillslut den tredje och sista (om det finns tillräckligt mycket av basen).
En bas är en protontagare. Det sker ingen protolys. Hydroxidjonerna finns redan i NaOH.
NaOH (s) + H2O (l) → Na+ (aq) + OH- (aq)Stämmer.
c) Det måste hända neutralisering tycker jag.C₆H₈O₇ (aq) + 3NaOH (aq) → Na3C6H5O7(aq) + 3 H2O(l)
Stämmer?Ja det sker en neutralisation. Men det är flera jämvikter (så tänk på pilen tillbaka).
Och eftersom din citronsyra har tre karboxylsyragrupper blir det tre jämvikter, som genom basen förskjuts mot den helt protolyserade formen C6H5O73- .
Tack för ditt svar.
men vad egentligen skulle jag skriva i b) kring hur citronsyra blandas i vatten?
Och vad skulle vara i c) ?
b) de jämviktsreaktionerna för citronsyran när den protolyseras, alla fyra former av citronsyran kan finnas, men den som lämnat ifrån sig en proton är nog den dominerande.
c) neutralisationsreaktionen. Om du antar att det finns ett överskott av hydroxidjoner kommer all citronsyra protolyseras helt, men det är fortfarande tre jämvikter som av basen förskjuts mot den helt protolyserade formen av citronsyran.
mag1 skrev:b) de jämviktsreaktionerna för citronsyran när den protolyseras, alla fyra former av citronsyran kan finnas, men den som lämnat ifrån sig en proton är nog den dominerande.
c) neutralisationsreaktionen. Om du antar att det finns ett överskott av hydroxidjoner kommer all citronsyra protolyseras helt, men det är fortfarande tre jämvikter som av basen förskjuts mot den helt protolyserade formen av citronsyran.
jag förstår inte hur det skulle verka i formeln.
Kan du skriva formeln?
Nej då gör jag ju din uppgift.
Börja med den första protolyseringssteget, som nedan, så är det bara för dig att fylla i resten.
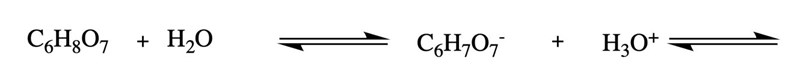
mag1 skrev:Nej då gör jag ju din uppgift.
Börja med den första protolyseringssteget, som nedan, så är det bara för dig att fylla i resten.
Och sedan С6H6O7- + H3O+ ⇄ С6H5O7- + H3O+
Stämmer?
Och på vilket sätt göras c) ?
Tack så mycket
AAnastasiia skrev:mag1 skrev:Nej då gör jag ju din uppgift.
Börja med den första protolyseringssteget, som nedan, så är det bara för dig att fylla i resten.
Och sedan С6H6O7- + H3O+ ⇄ С6H5O7- + H3O+
Stämmer?
För varje proton som försvinner så:
*ökar den negativa laddningen med 1. Så ändra laddningen.
*behövs en ny vattenmolekyl (H2O) som kan ta emot protonen. Så lägg till en till vattenmolekyl
Och på vilket sätt göras c) ?
Tack så mycket
Precis som i b) fast då tar hydroxidjonen emot protonen inte vattnet.
mag1 skrev:AAnastasiia skrev:mag1 skrev:Nej då gör jag ju din uppgift.
Börja med den första protolyseringssteget, som nedan, så är det bara för dig att fylla i resten.
Och sedan С6H6O7- + H3O+ ⇄ С6H5O7- + H3O+
Stämmer?För varje proton som försvinner så:
*ökar den negativa laddningen med 1. Så ändra laddningen.
*behövs en ny vattenmolekyl (H2O) som kan ta emot protonen. Så lägg till en till vattenmolekyl
Och på vilket sätt göras c) ?
Tack så mycketPrecis som i b) fast då tar hydroxidjonen emot protonen inte vattnet.
b) С6H8O7 + H2O ⇄ С6H7O7- + H3O+ ⇄ С6H6O72- + H3O+ + H2O+ ⇄ С6H5O73- + H3O+ + H2O2+
Stämmer?
c) С6H8O7 + H2O + 3NaOH + H2O ⇄ С6H7O7- + H3O+ + Na2- ⇄ С6H6O72- + H3O+ + H2O+ + Na3- ⇄ С6H5O73- + H3O+ + H2O2+
→ Na3C6H5O7(aq) + 3 H2O(l)
Oj. Kan du förklara lite mer vad skulle göras?
AAnastasiia skrev:b) С6H8O7 + H2O ⇄ С6H7O7- + H3O+ + H2O ⇄ С6H6O72- + 2 H3O+ + H2O⇄ С6H5O73- + 3 H2O+
Stämmer?
Nej inte riktigt. Jag fetmarkerade de delar som inte stämde. Det blir fler och fler H3O+ , men det är fortfarande endast denna molekyl som bildas. För varje protolysering sker 1 H2O + H+ => 1 H3O+ .
c) С6H8O7 + H2O + 3NaOH + H2O ⇄ С6H7O7- + H3O+ + Na2- ⇄ С6H6O72- + H3O+ + H2O+ + Na3- ⇄ С6H5O73- + H3O+ + H2O2+
→ Na3C6H5O7(aq) + 3 H2O(l)
Oj. Kan du förklara lite mer vad skulle göras?
Syran som är delvis protolyserad (finns nog mest av C6H7O7- ) kommer protolyseras vidare för att basen (OH-) tar emot protonerna och förskjuter jämvikten åt höger. Så vatten tar inte emot protonerna utan det gör basen.
Motsvarande C6H7O7- + OH- blir till CH6O72- + H2O, som sedan protolyseras vidare.
mag1 skrev:AAnastasiia skrev:b) С6H8O7 + H2O ⇄ С6H7O7- + H3O+ + H2O ⇄ С6H6O72- + 2 H3O+ + H2O⇄ С6H5O73- + 3 H2O+
Stämmer?
Nej inte riktigt. Jag fetmarkerade de delar som inte stämde. Det blir fler och fler H3O+ , men det är fortfarande endast denna molekyl som bildas. För varje protolysering sker 1 H2O + H+ => 1 H3O+ .
c) С6H8O7 + H2O + 3NaOH + H2O ⇄ С6H7O7- + H3O+ + Na2- ⇄ С6H6O72- + H3O+ + H2O+ + Na3- ⇄ С6H5O73- + H3O+ + H2O2+
→ Na3C6H5O7(aq) + 3 H2O(l)
Oj. Kan du förklara lite mer vad skulle göras?Syran som är delvis protolyserad (finns nog mest av C6H7O7- ) kommer protolyseras vidare för att basen (OH-) tar emot protonerna och förskjuter jämvikten åt höger. Så vatten tar inte emot protonerna utan det gör basen.
Motsvarande C6H7O7- + OH- blir till CH6O72- + H2O, som sedan protolyseras vidare.
b) С6H8O7 + H2O ⇄ С6H7O7- + H3O+ ⇄ С6H6O72- + 2 H3O+ ⇄ С6H5O733- + 3 H3O+
c) С6H8O7 + H2O + 3NaOH + H2O ⇄ С6H7O7- + OH- + Na2- ⇄ С6H6O72- + H2O+ + Na3- ⇄ С6H5O73- + OH ...vet inte...
→ Na3C6H5O7(aq) + 3 H2O(l)
Är b) ok?
Vad gäller c?
b) nej för varje H3O+ som skall bildas behövs en H2O i steget innan. Titta i föregående inlägg.
c) När saltet NaOH löses i vätska bildas, en positiv jon Na+ och en negativ jon OH-. OH- är basen som kan ta upp en proton och bilda vanligt vatten, H2O. Natriumjonen Na+ är och förblir Na+, den kan inte bilda Na2- eller Na3-.
Det som sker är att från lösningen med Na+ och OH- kommer OH- ta upp en proton och bilda vatten så med citronsyran kommer protonen från citronsyran så då blir första steget:
(C6H8O7 + Na+ + OH- <=> C6H7O7- + Na+ + H2O) och sedan fortsätter det i två steg till tills C6H5O73- bildats (och så klart motsvarande mängd vatten från protonerna och OH- som går åt).
mag1 skrev:b) nej för varje H3O+ som skall bildas behövs en H2O i steget innan. Titta i föregående inlägg.
c) När saltet NaOH löses i vätska bildas, en positiv jon Na+ och en negativ jon OH-. OH- är basen som kan ta upp en proton och bilda vanligt vatten, H2O. Natriumjonen Na+ är och förblir Na+, den kan inte bilda Na2- eller Na3-.
Det som sker är att från lösningen med Na+ och OH- kommer OH- ta upp en proton och bilda vatten så med citronsyran kommer protonen från citronsyran så då blir första steget:
(C6H8O7 + Na+ + OH- <=> C6H7O7- + Na+ + H2O) och sedan fortsätter det i två steg till tills C6H5O73- bildats (och så klart motsvarande mängd vatten från protonerna och OH- som går åt).
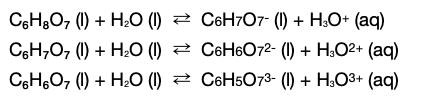
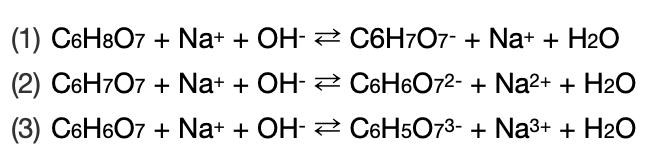 Stämmer? )
Stämmer? )
Glöm inte bort de negativa laddningarna på den protolyserade syran i (2) och (3), och samma ovanför. För det som bildas i (1) är det som reagerar vidare i (2) o.s.v.


