Titrering av okänd syra
Hej jag behöver hjälp med att bestäma syrans pKa värden och molmassa m.h.a titrerkurvan och en känd massa. Jag har dock problem att tolka kurvan och att hitta ekvivalenspunkten. Hur ska jag gå tillväga?
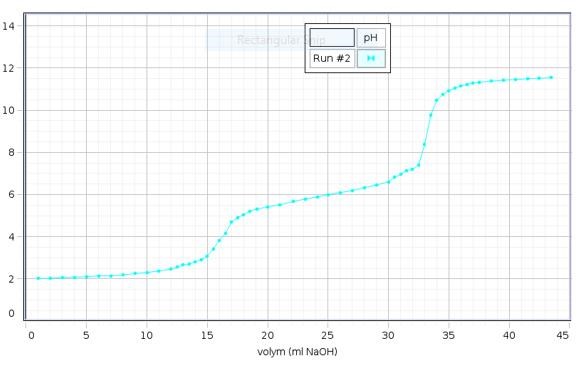
När titreringen börjar, har titranden (lösningen som titreras) ett lågt pH = 2. När man tillsätter de första 15 ml bas, ändras pH endast med 1 enhet, men när man sätter till ytterligare 4 ml ökar pH med 3 enheter. Där har du din första ekvivalenspunkt - vid ungefär 17 ml har du tillsatt lika många mol bas som vad det fanns syra från början. Vid ungefär 34 ml har du din andra ekvivalenspunkt - där har du tillsatt dubbelt så många mol bas som du hade syra från början.
Vet du hur du skall gör aför att hitta pKa-värdena?
Jag tog reda på Ekvivalenspunkten 1 som är ca 3,75 (16ml) pH och 2 som är ca 8,5 (33ml). Halvtitreringspunkten 1 är ca 2,25 pH (8ml) och 2 som är ca 3,5 (16,5ml). Hur gör jag nu? Bägaren har volymen 50 cm^3 = 0,5 dm^3, koncentrationen av natriumhydroxid är 0,100 mol/dm^3. Jag ska ta reda på syrans molmassa och utifrån det lista ut vilken syra jag har.
Du vet att du har lika många mol av syran som den substansmängd NaOH som finns i 16 ml NaOH-lösning med koncentrationen 0,100 mol/dm^3. Vet du hur många gram av syran du hade från början? När du vet m och n för syran kan du beräkna M.
När du vet vilken molmassan för den okända syran samt pKa1 och pKa2 bör det gå att leta upp vilken syra det kan vara. Har du någon tabell över pKa-värden?
Jag fattar inte riktigt, syrans massa är 0,180 g. Hur tar jag reda på substansmängden?
Spelar det roll vilken ekivalenspunkt man väljer alltså om n(NaOH) = n(okänd syra) ?
Du kan använda vilken ekvivalenspunkt du vill, bara du använder rätt reaktionsformel för den!
Så n(NaOH) = 0,100 * 0,16 = 0,016 mol vilket är syrans substansmängd? Om jag tar den andra volymen blir ju svaret annorlunda?
Nej, det blir samma eftersom n(NaOH) = 2n(syra) i det fallet. OK, lite mätfel får man köpa!
Mätfel?
Får det till 11,25 g/mol och det stämmer väl inte?
Det blir fel om jag tar M= m/n = 0,180/0,016.
Skulle du kunna förklara vad jag gör för fel?
Vilken substansmängd får du fram (du måste ha den först, innan du beräknar molmassan). Det finns ingen syra som har så låg molmassa som 11, 25 g/mol, så det stfämmer att det är fel.
plugga123 skrev :Mätfel?
Eftersom den ena ekvivalenspunkten är när man har tillsatt 16 ml NaOH och den andra när man har tillsatt 33 ml, och 33 inte är dubbelt så mycket som 16, så finns det ett mätfel i minst en av dem.
plugga123 skrev :Skulle du kunna förklara vad jag gör för fel?
Nej, eftersom du inte berättar precis vad du gör för något, så kan jag inte förklara vad du gör för fel. Skriv ordentligt precis hur du räknar, så kan jag hitta vad som går fel.
Använd t ex den första ekvivalenspunkten. Hur stor substanmängd fanns det av syran?
Hej!
Jag ska räkna skriva färdigt mina beräkningar och förklara vad jag kommit fram till, en sak jag tänkt på är om man ska dela den andra ekvivalenspunkten för pKa2 med 4 istället för 2, eftersom syran protoloyseras i två steg. Är det fel tankesätt?
Ska man använda samma koncentration NaOH som är 0,100 mol/dm^2 för att reda på substansmängden eller koncentrationen?
Ja, det är fel tankesätt. Du hittar pKa2 när du tillsatt 1,5 gånger så många mol hydroxidjoner som det fanns syramolekyler från början, d v s vid volymen 1,5*EP1 eller 0,75*EP2 (vilket bör bli samma volym om man inte har några felavläsningar av ekvivalensvolymerna).
Men då blir det inte hälften väl? Alltså EP2/2?
Nej, EP2/2 = EP1.
Hur går jag tillväga nu?
EP1 ~ 4,5 pH ( 16,5 ml = 0,0165 dm^3)
EP 2 ~ 8,75 pH ( 33 ml = 0,033 dm^3)
m(okänd syra) = 0,180 g
C(NaOH) = 0,100 mol/dm^3
n(NaOH) = n(okänd syra)
n(NaOH) = 0,100 * volymen vid Ep1?
Ska man ta volymen vid ekivalenspunkten 1 och isåfall ska jag sedan ta ett medelvärde av substansmängdena från både punkter? Sedan när jag har substansmängden är det bara att räkna ut syrans molmassa genom M= m/n?
Har även en tabell, men det jag tänker på är att svaret inte kommer bli exakt, är det bara ta det närmaste värdet?
Tack!!
Du kan räkna ut n(HA) för båda ekvivalenspunkterna, bara du tar hänsyn till att det är 2 mol NaOH som är ekvivalent med 1 mol HA vid EP2. Det var vettigt att beräkna ett medelvärde för n(HA) innan du beräknar M(HA).
Men det blir ju exakt samma svar, ska jag ta ett medelvärde ändå?
m(okänd syra) = 0,180 g
n(NaOH) = n(okänd syra)
n = C * V
n(NaOH) vid ekvivalenspunkten 1: 0,100 mol/dm^3 * 0,0165 dm^3 = 0,00165 mool = 1,65 * 10^ -3 mol
n(NaOH) vid ekvivalenspunkten 2: 0,100 mol/dm^3 * 0,033 dm^3/2= 0,00165 mol = 1,65 * 10^ -3 mol
ett medelvärde av n(NaOH) ger: (1,65 * 10^ -3 mol + 1,65 * 10^ -3 mol)/2 = 1,65 * 10^ -3 mol
⇒ n(okänd syra) = 1,65 * 10^ -3 mol
M = m/n
M(okänd syra) = (0,180 g/1,65 * 10^ -3 mol) = 109 g/mol
Jag har denna tabell:
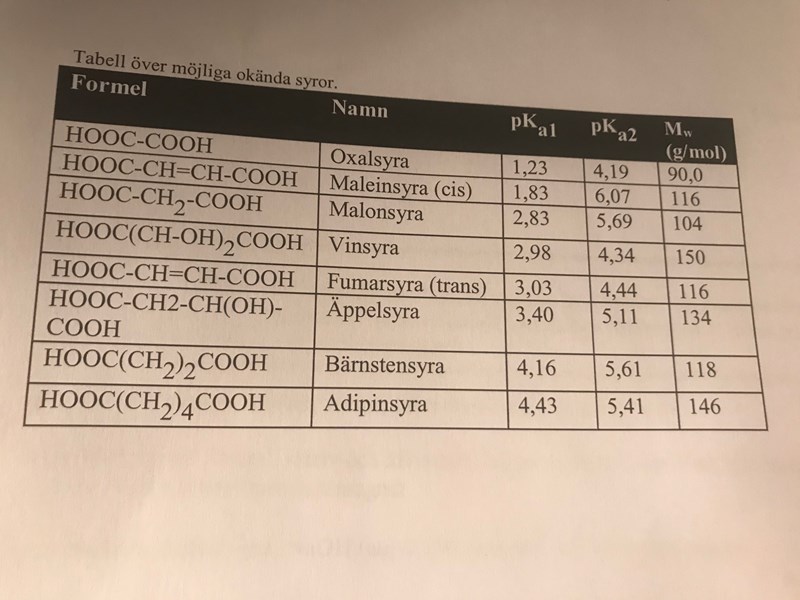
Kan det vara malonsyra?
Kan vara, eller maleinsyra, båda stämmer ungefär lika bra/dåligt.
Ok tack så mycket för din hjälp, det har hjälp mig väldigt mycket med min labbrapport!
Finns det några felkällor som skulle kunna tas upp, förutom felaktig mängd av koncentrantion av NaOH och upprepningar för ett mer tillförlitligt resultat? Labben gick ut att m.h.a titrering hitta ekvivalenspunkterna och pka-värdena och genom det lista ut molmassan av den okända syran. Jag använde mig av en dator och ett program som heter Capstone, magnetomrörare, elektrod och buffert för kalibrering. Nu är metod inte viktigt i just denna laboration, utan mer resultat, beräkningar och disskusion, men jag kommer inte på någon bra felkälla.
Avläsningen av ekvivalenspunkterna är väl den största felkällan.
Kalibrering av pH-metern är en annan möjlig felkälla. Blir den fel blir hela kurvan felaktig.


