Titrering laboration
Jag har fått retur på min labb som handlar om titrering. Jag har bara fått en kommentar: not correct.
Kan någon hjälpa mig med att hitta felet? Är det hela uträkningen som är fel så att jag måste börja om från början eller är det bara något slarvfel?
Labb:

Min felaktiga beräkning:
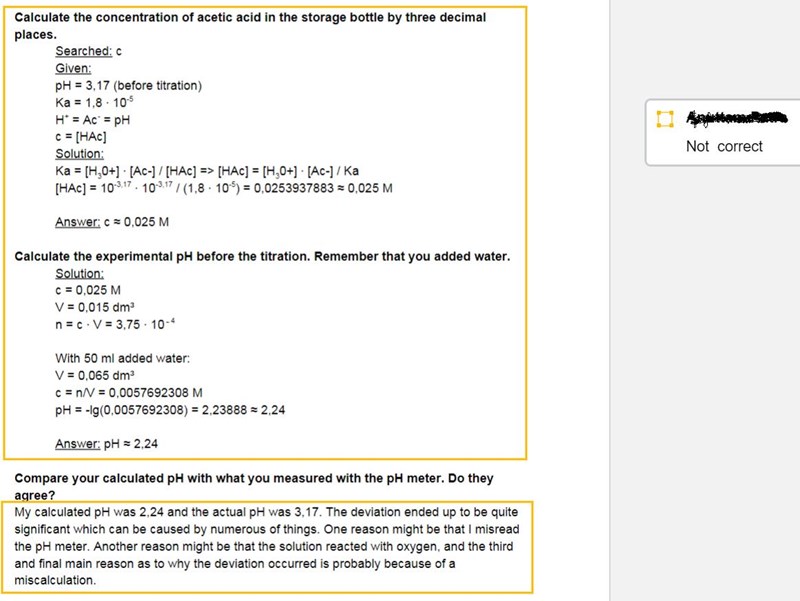
Är det här en labb du faktiskt har utfört eller är det en ”teoretisk laboration”?
Du har ju inte beräknat koncentrationen baserat på titreringen. Om du tänker igenom din lösning så inser du att man helt hade kunnat skita i titreringen och bara mäta pH-värdet. Du har bara tagit med pH-värdet i din beräkning, inget annat från labben.
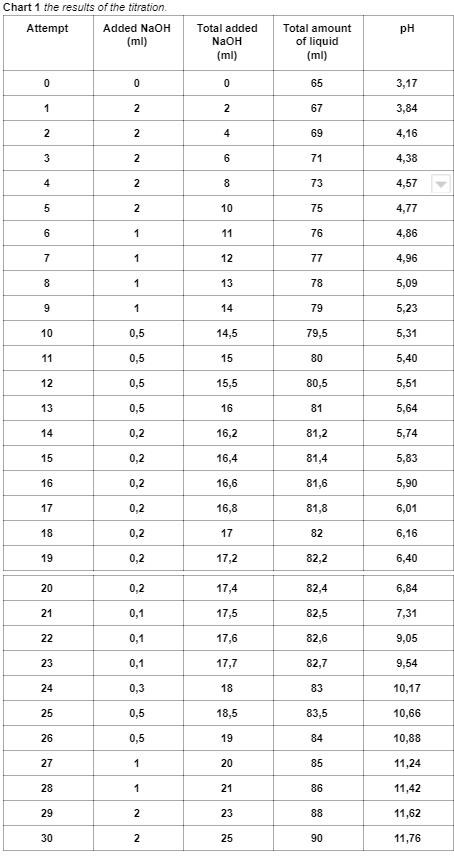
Du behöver läsa av titrerkurvan (ladda upp den här) och kolla var du har ekvivalenspunkten, sedan räkna ut hur många mol natriumhydroxid som då hade blivit tillsatt.
Teraeagle skrev:Är det här en labb du faktiskt har utfört eller är det en ”teoretisk laboration”?
Du har ju inte beräknat koncentrationen baserat på titreringen. Om du tänker igenom din lösning så inser du att man helt hade kunnat skita i titreringen och bara mäta pH-värdet. Du har bara tagit med pH-värdet i din beräkning, inget annat från labben.
Du behöver läsa av titrerkurvan (ladda upp den här) och kolla var du har ekvivalenspunkten, sedan räkna ut hur många mol natriumhydroxid som då hade blivit tillsatt.
Det är en labb som skulle ha utförts men pga corona fick vi se en video när våran professor gjorde den.
Första frågan är att "beräkna koncentrationen av ättiksyran i förrådsflaskan med tre decimaler". Förstår inte varför jag ska använda värden från själva labben då.
Andra uppgiften handlar om att beräkna pH innan titreringen. Tänker likadant där.
Skulle gärna vilja få det förklarat lite tydligare. Förstår inte riktigt vad jag räknar ut.
Vart fick du pH 3.17 ifrån?
Pikkart skrev:Vart fick du pH 3.17 ifrån?
Det var pH-värdet på ättiksyralösningen innan NaOH tillsattes.
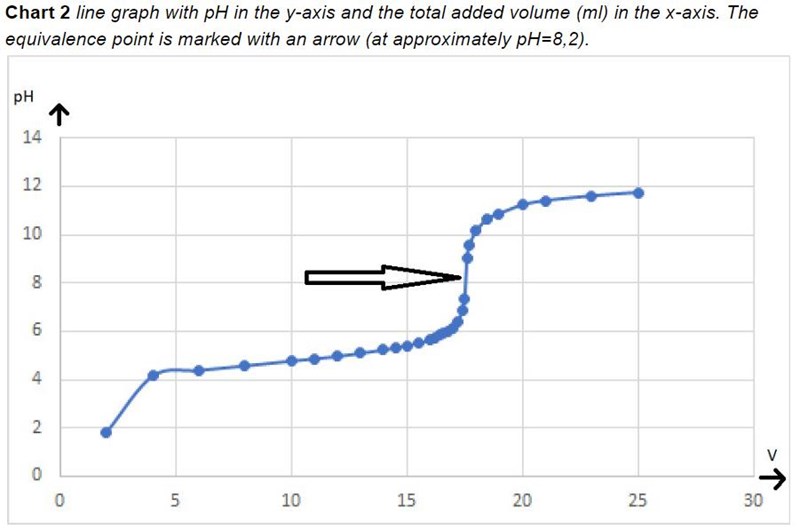
Vart framgår det? Enligt titreringskurvan så är pHInitial = 1.9 ungefär.
Pikkart skrev:Vart framgår det? Enligt titreringskurvan så är pHInitial = 1.9 ungefär.
Lade just till en tabell i förra inlägget där det beskrivs.
Enligt professorn var titreringskurvan samt tabellerna bra. Det var bara beräkningarna i mitt första inlägg som det var fel på.
Initialt så är koncentrationen av; HA=0.1M, A-=0, H+=0.
Förändringen blir ju -x
Vid jämvikt så är; HA=0.1-x, A-=x ,H+=x
Du har ju pH och vad är relationen mellan pH och koncentration av vätejoner? Det resultatet ger ju dig värdet på x. Vad är isåfall koncentrationen?
Pikkart skrev:Initialt så är koncentrationen av; HA=0.1M, A-=0, H+=0.
Förändringen blir ju -xVid jämvikt så är; HA=0.1-x, A-=x ,H+=x
Du har ju pH och vad är relationen mellan pH och koncentration av vätejoner? Det resultatet ger ju dig värdet på x. Vad är isåfall koncentrationen?
Jag förstår inte varför vi kan använda oss av koncentrationen 0,1 då det är det vi ska bestämma. I labbinstruktionerna står det ca 0,1 M.
Men har i alla fall räknat så här:
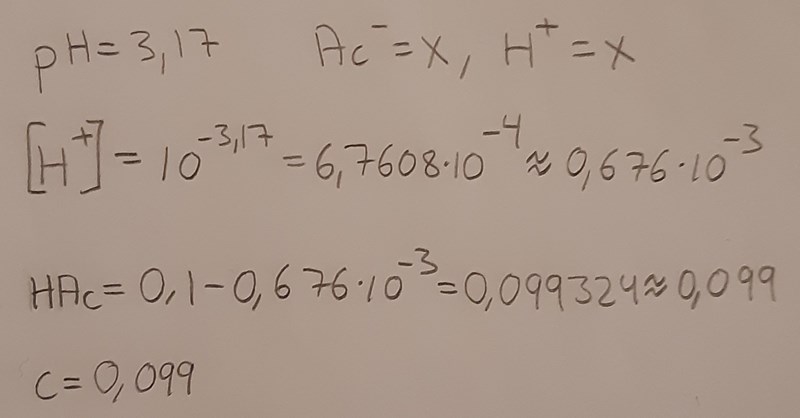
Försökte räkna pH-värdet också men det blev helt fel.
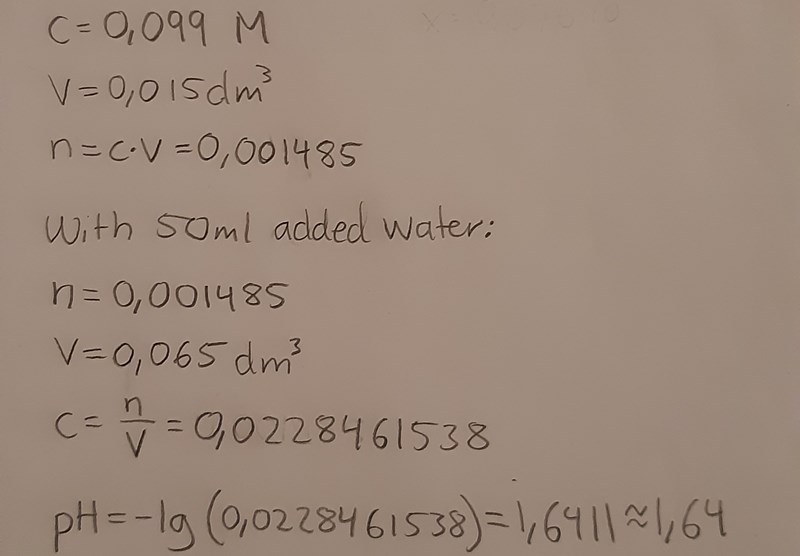
Tråden börjar bli rörig, är det koncentrationen eller pH du inte förstår?
Dvs. fråga 1 eller 2. Förövrigt håller jag med Teraeagle.
Pikkart skrev:Tråden börjar bli rörig, är det koncentrationen eller pH du inte förstår?
Dvs. fråga 1 eller 2. Förövrigt håller jag med Teraeagle.
Jag har bara fått att jag har gjort fel på båda frågorna men vet inte vad som blev fel. När jag gjorde de första uträkningarna kändes det rätt så nu vet jag inte vad det är jag har missförstått.
Jag förstår alltså inte 1 eller 2.
Det jag inte heller förstår är hur jag ska räkna med värdena från titreringen om frågorna går ut på att beräkna koncentrationen och pH-värdet innan titrering.
Du behöver repetera vad titrering är för något och hur man räknar, kolla på något exempel i boken! Tanken är att man droppvis tillsätter en titrator, i detta fall lösningen med natriumhydroxid, till titranden (lösningen med ättiksyra) och läser av pH-värdet. När man har nått ekvivalenspunkten i en syrabastitrering som denna har man tillsatt lika många mol hydroxidjoner som det fanns av syran i titranden från början.
Om man hade titrerat 50,0 ml saltsyra med 0,100 mol/dm3 natriumhydroxid och det gick åt 20,0 ml till ekvivalenspunkten innebär det att man har tillsatt 0,100*0,0200=0,0020 mol natriumhydroxid. Eftersom det går åt en mol natriumhydroxid per mol saltsyra vid reaktionen måste det ha funnits 0,0020 mol saltsyra i provet från början. Då volymen var 50,0 ml var den ursprungliga koncentrationen 0,0020/0,0500=0,040 mol/dm3.
Gör nu på motsvarande sätt i ditt exempel med ättiksyra.
mattelinnea skrev:Pikkart skrev:Vart fick du pH 3.17 ifrån?
Det var pH-värdet på ättiksyralösningen innan NaOH tillsattes.
Kontrollera din kurva igen. Pikkart har alldeles rätt - enligt din tabell var ursprungliga pH 3,17 medan grafen säger att det var runt 1,9 när du hade tillsatt 2-2,5 ml av titratorn (då måste ursprungligt pH ha varit <1,9 eftersom titratorn höjer pH-värdet i titranden). Om din lärare inte kommenterade detta så har hen missat det vid rättningen.
Jag misstänker att du har använt Google Sheets för att rita grafen? Det programmet är ökänt för att göra fel när man ritar figurer. Använd Excel istället om du har möjlighet.
Se den här tråden:
Teraeagle skrev:Du behöver repetera vad titrering är för något och hur man räknar, kolla på något exempel i boken! Tanken är att man droppvis tillsätter en titrator, i detta fall lösningen med natriumhydroxid, till titranden (lösningen med ättiksyra) och läser av pH-värdet. När man har nått ekvivalenspunkten i en syrabastitrering som denna har man tillsatt lika många mol hydroxidjoner som det fanns av syran i titranden från början.
Om man hade titrerat 50,0 ml saltsyra med 0,100 mol/dm3 natriumhydroxid och det gick åt 20,0 ml till ekvivalenspunkten innebär det att man har tillsatt 0,100*0,0200=0,0020 mol natriumhydroxid. Eftersom det går åt en mol natriumhydroxid per mol saltsyra vid reaktionen måste det ha funnits 0,0020 mol saltsyra i provet från början. Då volymen var 50,0 ml var den ursprungliga koncentrationen 0,0020/0,0500=0,040 mol/dm3.
Gör nu på motsvarande sätt i ditt exempel med ättiksyra.
Jag har fått godkänt på saltsyra-delen av labben så jag använde mig av samma sätt nu. Problemet är att jag inte använder uppställningen jag blev tipsad om tidigare i den här tråden. Använder mig inte heller av Ka som vi har använt oss av vid beräkning av svaga syror i den här kursen.
(Vid ekvivalenspunkten hade 17,55 ml NaOH tillsatts)
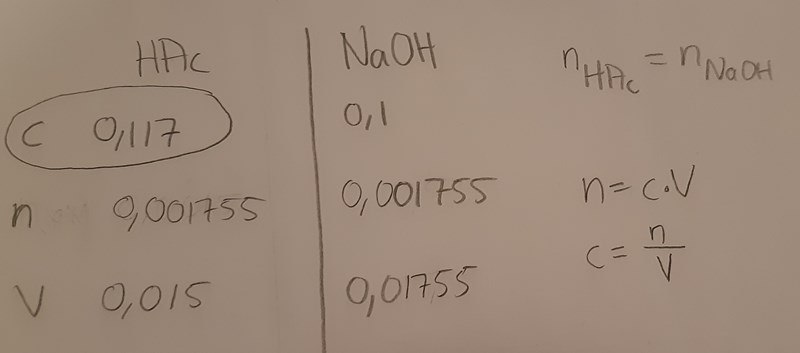
Nu har jag också beräknat pH-värdet innan titreringen vilket blev ganska likt det faktiska pH-värdet som var 3,17.
Tänker jag fortfarande fel?
(Ka är taget ur en formelsamling).
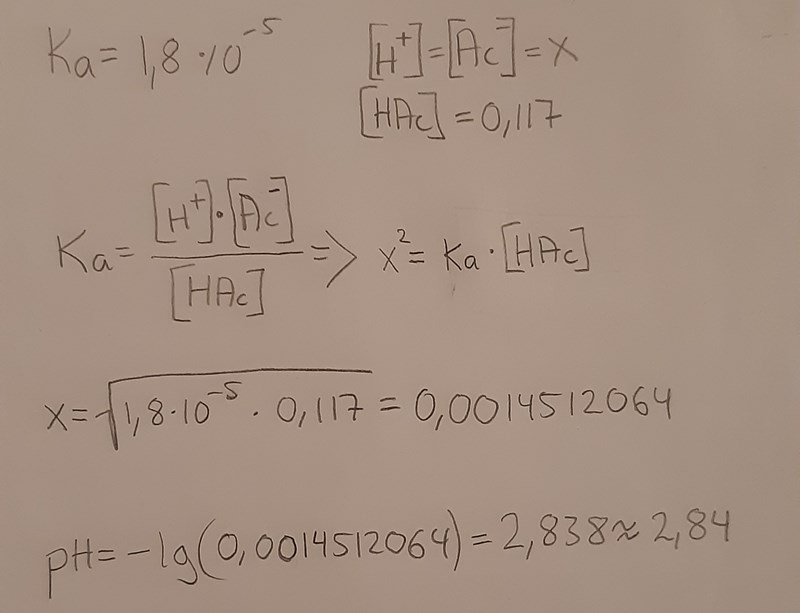
mattelinnea skrev:Nu har jag också beräknat pH-värdet innan titreringen vilket blev ganska likt det faktiska pH-värdet som var 3,17.
Tänker jag fortfarande fel?
(Ka är taget ur en formelsamling).
Det var precis det här jag skrev där uppe men jag vågar inte lova något då jag inte hänger med alls i vad det är du har gjort. Teraeagle kanske kan tyda bättre!
Bra, nu verkar du åtminstone ha löst a-uppgiften korrekt, dvs koncentrationen var 0,117 mol/dm3 i flaskan.
Ditt x i b-uppgiften anger dock pH-värdet i flaskan, men du skulle bestämma pH-värdet innan titreringen (dvs efter vattentillsatsen). Gör på motsvarande sätt, fast räkna ut koncentrationen i lösningen efter utspädning om den var 0,117 mol/dm3 innan utspädningen. Du måste också förklara varför du kan skriva om jämviktsekvationen som du gör. Man gör en approximation baserat på sina kemiska kunskaper - för en matematiker som inte kan kemi skulle din omskrivning verka konstig.
Teraeagle skrev:Bra, nu verkar du åtminstone ha löst a-uppgiften korrekt, dvs koncentrationen var 0,117 mol/dm3 i flaskan.
Ditt x i b-uppgiften anger dock pH-värdet i flaskan, men du skulle bestämma pH-värdet innan titreringen (dvs efter vattentillsatsen). Gör på motsvarande sätt, fast räkna ut koncentrationen i lösningen efter utspädning om den var 0,117 mol/dm3 innan utspädningen. Du måste också förklara varför du kan skriva om jämviktsekvationen som du gör. Man gör en approximation baserat på sina kemiska kunskaper - för en matematiker som inte kan kemi skulle din omskrivning verka konstig.
Okej tack!
Menar du att jag ska förklara med ord eller räcker det med att förtydliga stegen som jag har gjort nu?

Egentligen ska det stå [HAc]-x i nämnaren, eftersom en liten del av ättiksyran genomgår protolys och bildar vätejoner och acetatjoner. Eftersom syrakonstanten är otroligt liten (<<1) kan man göra approximationen
och då blir ekvationen mycket enklare att lösa. Annars får man en andragradsekvation som löses med pq-formeln, vilket du kanske känner till om du har läst matte 2.
Teraeagle skrev:Egentligen ska det stå [HAc]-x i nämnaren, eftersom en liten del av ättiksyran genomgår protolys och bildar vätejoner och acetatjoner. Eftersom syrakonstanten är otroligt liten (<<1) kan man göra approximationen
och då blir ekvationen mycket enklare att lösa. Annars får man en andragradsekvation som löses med pq-formeln, vilket du kanske känner till om du har läst matte 2.
Förstår inte riktigt, har jag gjort fel eller är det bara en "ful" lösning? För svaret blir ju väldigt likt 3,17.
Ful lösning, skulle man kunna säga. Eller snarare att du går från a till c istället för att gå från a till b till c. Lösningen är inte komplett, men svaret är rätt.



