Varför blir järn svart i en vattenlösning med citronsyra?
Hej,
Jag utförde ett experiment där jag la en bit stål i en vattenlösning med citronsyra. Efter ett par dagar blev lösningen grönfärgad och stålbiten blev svart. Varför blir lösningen grön och stålbiten svart?
Tips: järn(II)-joner brukar ha en grönaktig färg. Metaller korroderar snabbt i en sur miljö och tappar då sin metallglans.
Teraeagle skrev:Tips: järn(II)-joner brukar ha en grönaktig färg. Metaller korroderar snabbt i en sur miljö och tappar då sin metallglans.
Men varför har inte säg en vattenlösning med salt och stål en grönaktig färg? Järnet korroderar väl även snabbare i en saltlösning eftersom lösningen har ökad ledningsförmåga och joner rör sig runt omkring snabbare? Och varför just svart färg? När järn korroderar ska väl det bilda järnoxidhydroxider (rost) som har en "rost"/brun/orange färg?
Citronsyra används väl som ett medel för att ta bort rost också från järnspikar, vad har detta för sammanhang i det hela?
Tacksam för svar :)
Det blir olika korrosionsprodukter, vilket man bl.a. kan se med ett Pourbaix-diagram:
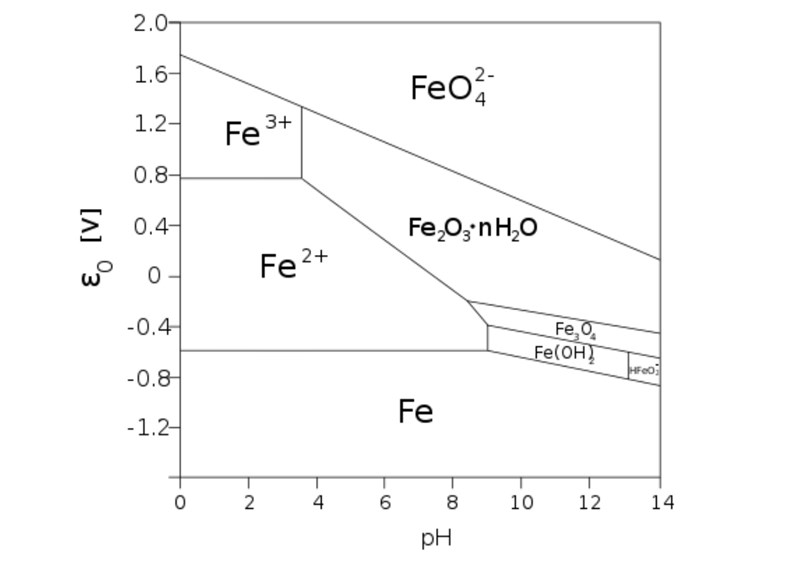
Ett väl syresatt vatten har en redoxpotential runt 0,4 V. I fallet med citronsyra kommer pH att vara lågt och det är Fe2+(aq) som är den stabila formen av järn. Fe2+ ger lösningen en grön färg.
I en vanlig saltlösning är pH betydligt högre och då är Fe2O3(s) den stabila formen av järn. I princip är detta en form av rost, men rost är inte ett enskilt ämne utan ett samlingsnamn för föreningar mellan järn, syre och väte. Fe2O3 är den form som är stabil och kommer att ha bildats efter en oändlig tid, men man kan få andra typer av rost som mellanprodukter (exempelvis FeOOH). Det viktiga är att järn kommer att bilda trevärda joner vid icke-surt pH och dessa fälls nästan alltid ut ur lösningen då deras salter tenderar att vara svårlösliga.
Att stålbiten blir svart i lösningen med citronsyra hänger troligen ihop med koncentrationsgradienter. Vid lågt pH borde det ju inte fällas ut någon fast järnförening (rost), utan det är Fe2+(aq) som är stabil. Problemet är att vätejonerna alldeles bredvid järnytan kommer att reagera med den och bilda vätgas. Då får man en sänkning av [H+] intill ytan och det ger lokalt ett högre pH som tillåter bildandet av någon typ av mörk rost. Vätejonerna måste sedan diffundera från lösningen till järnytan för att motverka denna koncentrationsgradient. Själva regionen med lokalt högre pH kallas för diffusionslager och det är av samma anledning som en del kemiska reaktioner som involverar en vätska och ett fast ämne tenderar att gå snabbare vid omrörning. Då bryts diffusionslagret ner och blir tunnare så att reaktionen påskyndas. Man kan även få en del problem vid elektrolys eftersom diffusionslaget kan påverka vilka reaktioner som sker, vilket har det vackra namnet diffusionsöverpotential.
Teraeagle skrev:Det blir olika korrosionsprodukter, vilket man bl.a. kan se med ett Pourbaix-diagram:
Ett väl syresatt vatten har en redoxpotential runt 0,4 V. I fallet med citronsyra kommer pH att vara lågt och det är Fe2+(aq) som är den stabila formen av järn. Fe2+ ger lösningen en grön färg.
I en vanlig saltlösning är pH betydligt högre och då är Fe2O3(s) den stabila formen av järn. I princip är detta en form av rost, men rost är inte ett enskilt ämne utan ett samlingsnamn för föreningar mellan järn, syre och väte. Fe2O3 är den form som är stabil och kommer att ha bildats efter en oändlig tid, men man kan få andra typer av rost som mellanprodukter (exempelvis FeOOH). Det viktiga är att järn kommer att bilda trevärda joner vid icke-surt pH och dessa fälls nästan alltid ut ur lösningen då deras salter tenderar att vara svårlösliga.
Att stålbiten blir svart i lösningen med citronsyra hänger troligen ihop med koncentrationsgradienter. Vid lågt pH borde det ju inte fällas ut någon fast järnförening (rost), utan det är Fe2+(aq) som är stabil. Problemet är att vätejonerna alldeles bredvid järnytan kommer att reagera med den och bilda vätgas. Då får man en sänkning av [H+] intill ytan och det ger lokalt ett högre pH som tillåter bildandet av någon typ av mörk rost. Vätejonerna måste sedan diffundera från lösningen till järnytan för att motverka denna koncentrationsgradient. Själva regionen med lokalt högre pH kallas för diffusionslager och det är av samma anledning som en del kemiska reaktioner som involverar en vätska och ett fast ämne tenderar att gå snabbare vid omrörning. Då bryts diffusionslagret ner och blir tunnare så att reaktionen påskyndas. Man kan även få en del problem vid elektrolys eftersom diffusionslaget kan påverka vilka reaktioner som sker, vilket har det vackra namnet diffusionsöverpotential.
Tack så mycket för ditt svar, uppskattar tiden du la på att svara!
Du är guld, tack så jättemycket att du lägger tid på att lära oss ungdomar!


