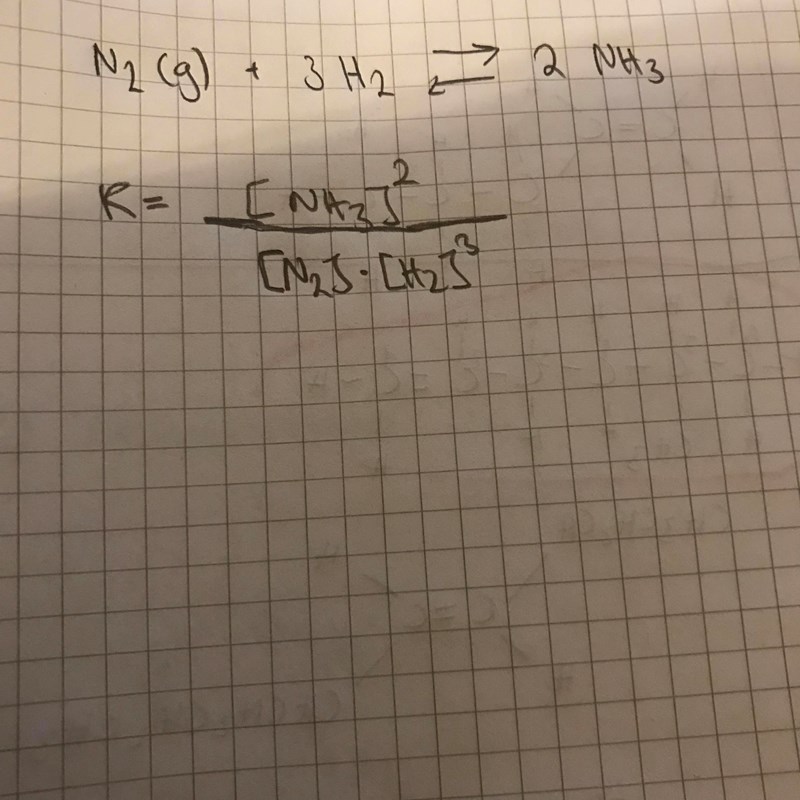Varför gynnar en tryckökning en reaktion?
Hej, i min kemibok står det att en tryckökning gynnar den reaktionen som medför att substansmängden gas minskar. Jag undrar varför det gör det.
Testa att skriva en sån reaktion! Hur blir jämviktsuttrycket? Enligt ideala gaslagen kan du skriva om koncentrationen för en gas som p(gasen)/RT, eftersom pV=nRT ger n/V=p/RT och vi vet ju att koncentationen är n/V.
Nu kan du ersätta [NH3] med p(NH3)/RT och göra på motsvarande sätt för väte och kväve. Du kan sen förkorta bort några R och T. Vad får du? Till sist ersätter du respektive partialtryck med molbråket*totaltrycket, dvs x(ämne)*P. Då utnyttjar du Daltons lag. Nästa steg är att förkorta bort P på de ställen där det går.
Jag förstår inte formlerna du nämner. Hör inte de ihop med fysiken?
Tänk om världen var så pass enkel att man kunde dela upp den i tre naturvetenskaper som aldrig överlappade med varandra :)
Förstår du hur du ska ställa upp det hela eller var fastnar du?
Aa jag vet att de överlappar varandra, men min kemilärare har aldrig nämnt att man kan använda sig av den formeln när man beräknar jämvikt. Det är därför jag blir förvirrad .
Formeln överhuvudtaget... Alltså vad är p(NH3)/RT och varför kan jag ersätta det med [NH3]. Kan man inte gå genom koncentrationen?
Jo, visst kan man gå över koncentrationerna. Hur gör du för att beräkna koncentrationen för en gas?
Förresten, så här skiljer man mellan de tre naturvetenskaperna:
Om det är grönt eller rör sig ............... biologi
Om det stinker .........................kemi
Om det inte fungerar ..................... fysik
Så var det i alla fall någon som förklarade det för mig!
Du har reaktionen:
Vilket ger jämviktsekvationen:
Nu kan vi utnyttja ideala gaslagen , fast på formen för att skriva om jämviktsekvationen. Vi får att
Genom att utnyttja Daltons lag, vilken säger att där x är molfraktionen av ämnet och P är totaltrycket, kan vi göra den sista omskrivningen
Nu kan vi ersätta koncentrationerna i jämviktsekvationen med uttrycket längst till höger här på raden ovanför.
Slutligen kan vi exempelvis lösa ut molfraktionen av kvävgas (dvs hur stor andel av gasen som kommer att utgöras av kvävgas vid jämvikt):
Vad säger den här ekvationen? Jo, att om vi ökar totaltrycket P, så kommer vi att ha mindre kvävgas vid jämvikt, eftersom är omvänt proportionell mot . Det är åtminstone mitt sätt att tänka.