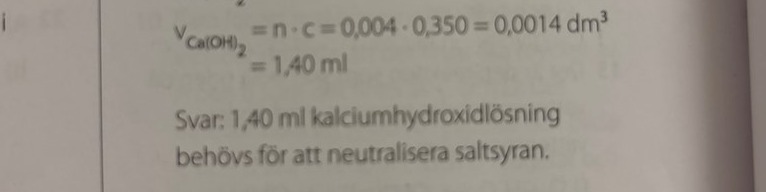5.27 neutralisationsreaktion
Hur ska jag veta att reaktionsformeln inte ser ut såhär


Då får jag ställa en motfråga, eftersom jag är nyfiken på hur du tänker:
Varför skulle det bli CaHCl?
Det är ett ämnet som inte finns, bland annat för att det inte är neutralt. Laddningarna balanserar inte varandra. Fantiserar man lite, så skulle vi kunna hitta på CaHCl3. Det ämnet finns inte heller, men är åtminstone laddningsneutralt.
En neutralisationsreaktion mellan en syra och en bas ger alltid ett salt (+ vatten). I det här fallet bildas kalciumklorid.
Syrans H+ reagerar med basens OH- och bildar H20.
Kvar blir Ca2+ och Cl- som ger saltet CaCl2.
Laddningarna är balanserade och vi har ett stabilt välkänt salt + vatten. Klor tillhör dessutom halogenerna, som betyder "saltbildare".
sictransit skrev:Då får jag ställa en motfråga, eftersom jag är nyfiken på hur du tänker:
Varför skulle det bli CaHCl?
Det är ett ämnet som inte finns, bland annat för att det inte är neutralt. Laddningarna balanserar inte varandra. Fantiserar man lite, så skulle vi kunna hitta på CaHCl3. Det ämnet finns inte heller, men är åtminstone laddningsneutralt.
En neutralisationsreaktion mellan en syra och en bas ger alltid ett salt (+ vatten). I det här fallet bildas kalciumklorid.
Syrans H+ reagerar med basens OH- och bildar H20.
Kvar blir Ca2+ och Cl- som ger saltet CaCl2.
Laddningarna är balanserade och vi har ett stabilt välkänt salt + vatten. Klor tillhör dessutom halogenerna, som betyder "saltbildare".
Tack!
Visst är det fel i facit här?


Ha en fin dag skrev:Visst är det fel i facit här?
Ja, facit har inte räknat ut en volym, utan något spännande med enheten mol2/dm3. Dividerar man istället med koncentrationen får man ca 11,4 ml.