Additionsreaktioner dubbelbindning
I en additionsreaktion med etan och brommolekyl bildas två bindningar mellan brom och kol 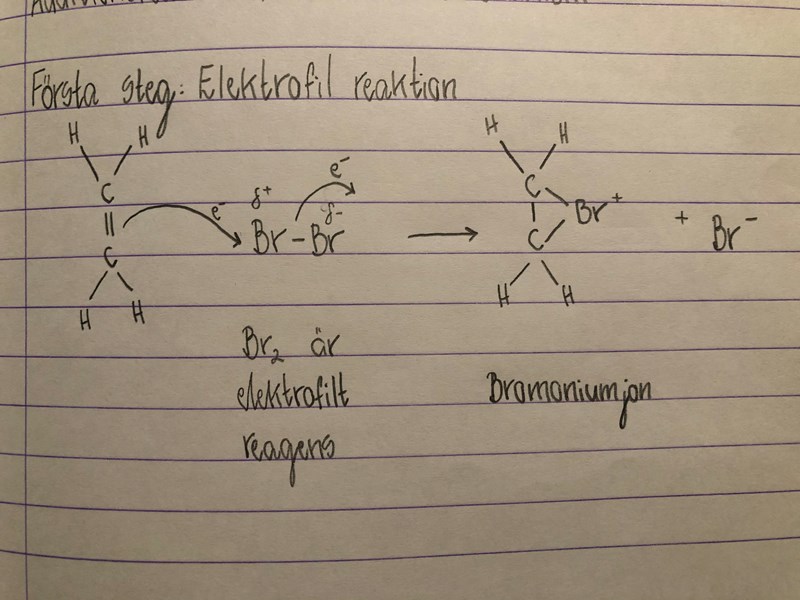
Men när etan gör en elektrofil attack på HCl så binder H bara med en bindning.  Varför?
Varför?
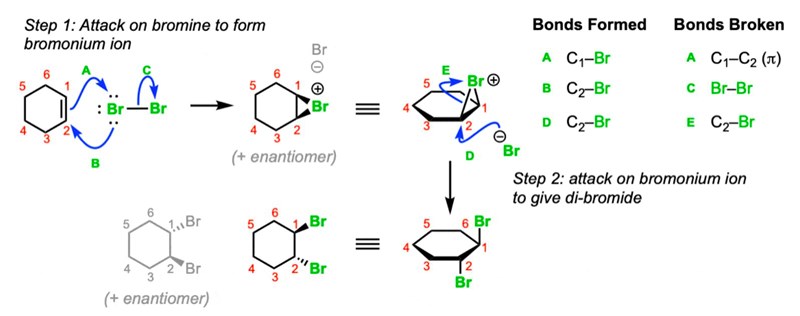
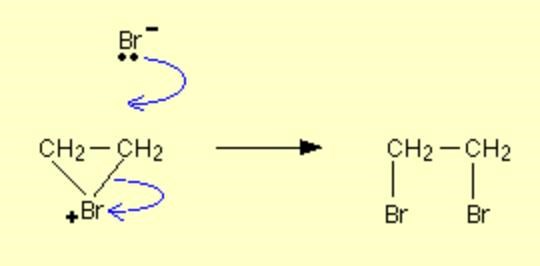
Din första reaktion reagerar bromgasen i två steg, med två jämbördiga och reaktiva bromatomer. Först bildas bromoniumjonen och en bromjon (som du visat). Bromoniumjonen har en positiv laddning och den lilla ringen har är energimässigt oönskad så denna jon kommer reagera vidare. Den bildande bromjonen kommer adderas till ett av kolen, och den då redan bundna bromatomen hamnar på den andra kolatomen (CH2Br-CH2Br).
Din andra reaktion sker additionen med den väldigt polariserade HCl molekylen, där vätet abstraheras av dubbelbindningen, och kloratomen lämnar då som kloridjon (väldigt bra lämnande grupp). Kloridjonen kommer sedan mer än gärna attackera den bildade karbokatjonen och adderas.
mag1 skrev:Din första reaktion reagerar bromgasen i två steg, med två jämbördiga och reaktiva bromatomer. Först bildas bromoniumjonen och en bromjon (som du visat). Bromoniumjonen har en positiv laddning och den lilla ringen har är energimässigt oönskad så denna jon kommer reagera vidare. Den bildande bromjonen kommer adderas till ett av kolen, och den då redan bundna bromatomen hamnar på den andra kolatomen (CH2Br-CH2Br).
Din andra reaktion sker additionen med den väldigt polariserade HCl molekylen, där vätet abstraheras av dubbelbindningen, och kloratomen lämnar då som kloridjon (väldigt bra lämnande grupp). Kloridjonen kommer sedan mer än gärna attackera den bildade karbokatjonen och adderas.
Jag vet inte om det är jag som missar något, men jag förstår inte varför det första bromet binder till båda kolen? 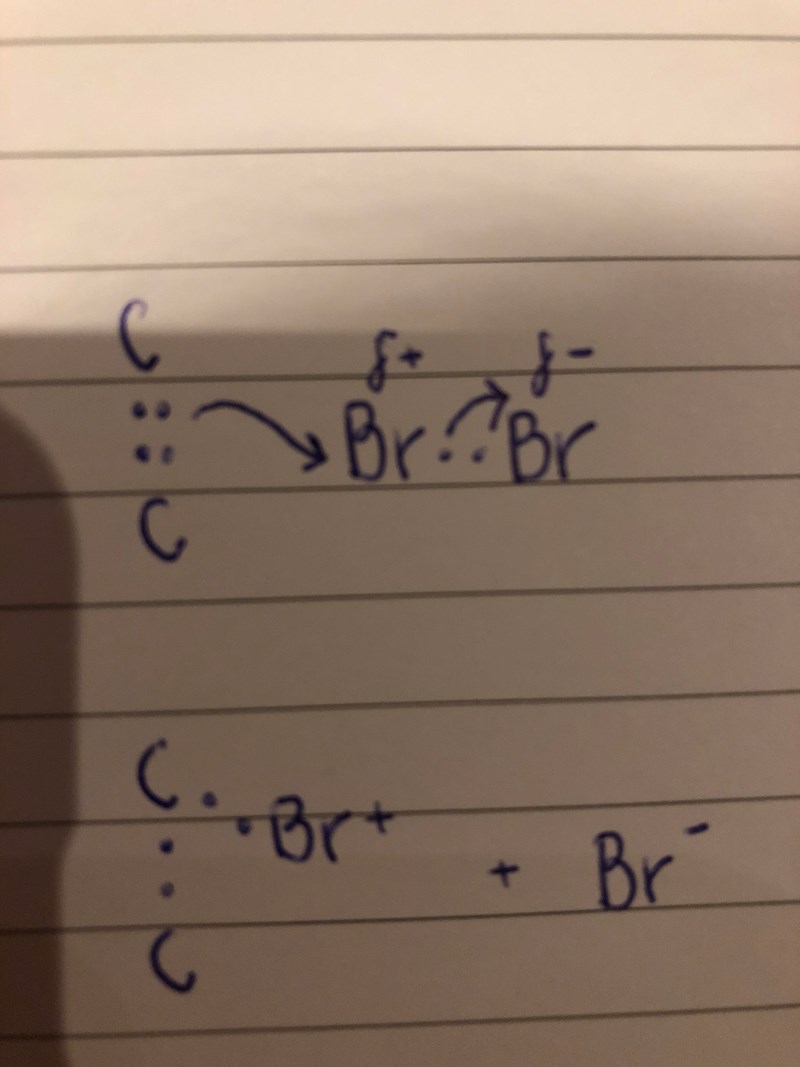
Jag försökte rita upp det här för att visa vad jag menar. Alltså, om elektronparet i brommolekylen går till ena bromet så blir den ju negativt laddad. Då har den andra bromatomen inga elektroner att binda till kolen med, utan binder endast med kolens egna elektronpar (som kommer från ena dubbelbindningen). Då borde väl Br bara binda till ett kol? Eller binder bromet till kolatomerna med andra valenselektroner än de som ingick i bindningen till den andra bromatomen, för de har väl övergått till den andra bromatomen (eftersom den är negativ nu). Jag vet inte om du förstår hur jag tänker, blev lite rörigt men försökte förtydliga med bilden.
Reaktionen fortsätter efter det steget:
Smaragdalena skrev:Reaktionen fortsätter efter det steget:
Ja, alltså bromidjonen binder väl in eftersom den är negativt laddad och "tog" elektronerna som var i bindningen till det andra bromet, men i min översta bild så binder det första bromet (det som är "positivt") till båda kolatomerna, och jag fattar inte hur det går till? Det borde ju bara binda in till det ena kolet eftersom den binder in med hjälp av dubbelbindningen mellan kol och kol. Och sen när bromidjonen kommer så binder den in med elektronerna som den tog från brommolekylbindningen. Så min fråga är egentligen, varför man i första bilden ritar att det positiva bromet binder till båda kolatomerna, borde det inte bara vara ena? Jag vet inte om din bild förklarade det men jag tolkade den som att den visade varför bromidjonen binder in.
Elektronerna från dubbelbindningen måste "välja" vilken av kolatomerna de skall släppa från. Det är energimässigt och geometriskt osannolikt att det skulle bli en bindning mellan alla tre atomerna.
sund20 skrev:
Ja, alltså bromidjonen binder väl in eftersom den är negativt laddad och "tog" elektronerna som var i bindningen till det andra bromet, men i min översta bild så binder det första bromet (det som är "positivt") till båda kolatomerna, och jag fattar inte hur det går till? Det borde ju bara binda in till det ena kolet eftersom den binder in med hjälp av dubbelbindningen mellan kol och kol. Och sen när bromidjonen kommer så binder den in med elektronerna som den tog från brommolekylbindningen. Så min fråga är egentligen, varför man i första bilden ritar att det positiva bromet binder till båda kolatomerna, borde det inte bara vara ena? Jag vet inte om din bild förklarade det men jag tolkade den som att den visade varför bromidjonen binder in.
I den första bromen, induceras en dipol - bromatomen närmast dubbelbindningen får aningen lägre elektrontäthet (deltaplus) och den andra får lite högre (deltaminus). Det som då sker är att dubbelbindningen tillsammans med bromen skapar de två bindningarna till den deltapositiva bromatomen, men elektronpar från både bromen och dubbelbindningen deltar.
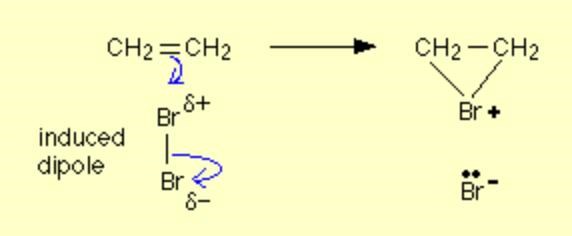
Samtidigt tillfaller bägge elektronerna i bindningen mellan bromatomerna i bromgasen den andra bromen som då bildar en bromidjon. I och med att bägge kolatomerna binder till samma brom som lämnat ifrån sig en elektron blir det en positivt laddad jon, som inte hamnar på något av kolen utan på bromen, för att det går (med bl.a. Br2) - till skillnad från t.ex. HCl där vätet adderas först till en av kolatomerna och med den positiva laddningen som en karbokatjon då det andra kolet.
Motsvarande med mer detaljer, bl.a. elektronparen som skapar bindningarna (i detta fall cycklohexen