Ädelgasstruktur
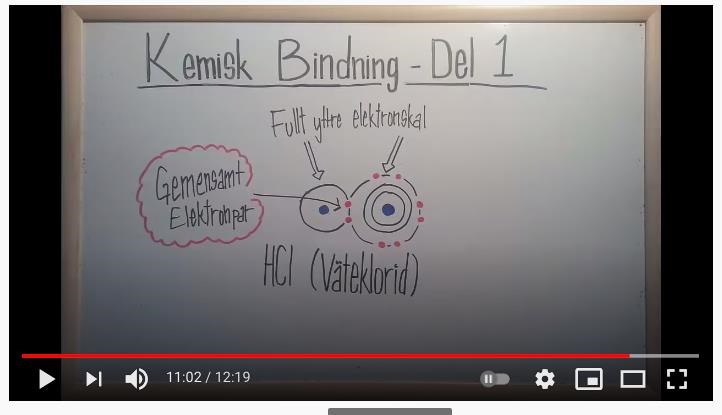
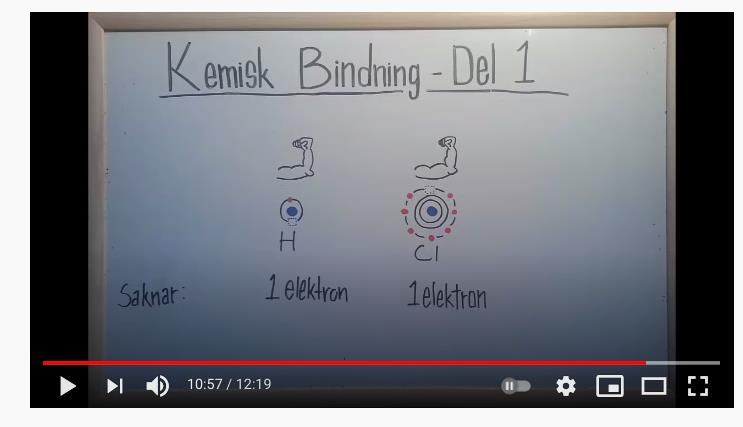
Hejsan är lite förvirrad. Jag har alltid trott att man ska ge bort eller ta upp e- för att uppnå ädelgasstruktur. Då tänker jag att H borde ge bort sin e- till Cl för att de båda ska uppnå ädelgasstruktu. Men nu handlar detta om kovalenta bindningar och hänger inte riktigt med på varför H ska ta upp en elektron till som den delar med Cl. Då har den ju 2e- med Cl har 8e-
??????
Tacksam för svar.
Det du har hört gäller när man har en metall och en icke-metall, d v s en atom som lätt tappar bort en elektron (eller fler) och en atom som gärna tar upp en elektron (eller flera). Men om båda atomerna helst "vill" ta upp en extra elektron för att få ädelgasstruktur så kan de båda atomerna dela på två elektroner istället. När väte får en extra elektron så har den ju ädelgasstruktur - samma elektronstruktur som ädelgasen helium.
Smaragdalena skrev:Det du har hört gäller när man har en metall och en icke-metall, d v s en atom som lätt tappar bort en elektron (eller fler) och en atom som gärna tar upp en elektron (eller flera). Men om båda atomerna helst "vill" ta upp en extra elektron för att få ädelgasstruktur så kan de båda atomerna dela på två elektroner istället. När väte får en extra elektron så har den ju ädelgasstruktur - samma elektronstruktur som ädelgasen helium.
Så väte uppnår ädelgasstruktur när den hae 2 e-?
Tack!
Ja, fast väte är en ganska konstig atom, just för att den är så liten. Väte kan bilda både positiva vätejoner H+ och negativa hydridjoner H-. Vätejoner är viktiga när man håller på med syror och baser (men den fastnar alltid på en vattenmolekyl).
Smaragdalena skrev:Ja, fast väte är en ganska konstig atom, just för att den är så liten. Väte kan bilda både positiva vätejoner H+ och negativa hydridjoner H-. Vätejoner är viktiga när man håller på med syror och baser (men den fastnar alltid på en vattenmolekyl).
Uppnår en väteatom ädelgasstruktur, om den avger sin enda elektron?
Uppnår en väteatom ädelgasstruktur, om den avger sin enda elektron?
Nej, det kan man inte påstå. Vätejonen är extremt reaktiv och reagerar med vilken bas som helst som finns i närheten, så att det bildas en mycket mer stabil syra. Vanligen är det en vattenmolekyl som finns i närheten.



