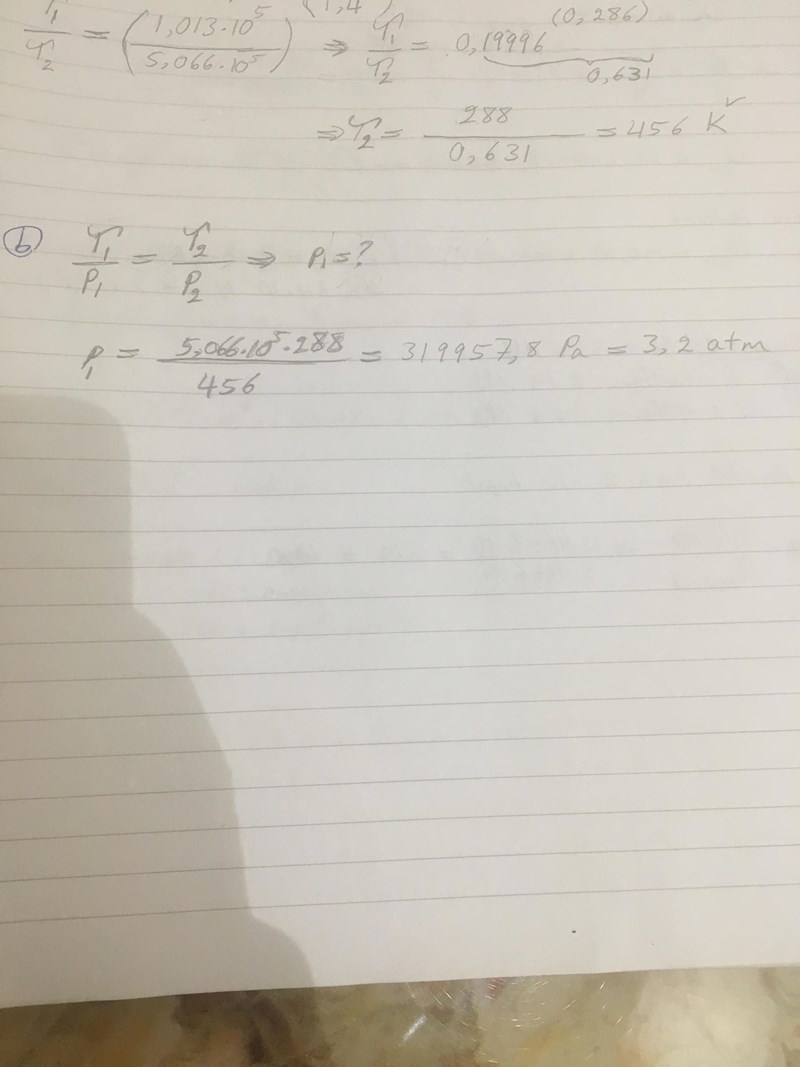Adiabatisk process
Hej! I denna uppgift har jag lyckats med att hitta temperaturen som är 456 K, men vet inte på (b) delen hur skall jag tänka å vilken formel måste jag använda?
Repetition av Fy1 och Ke1: Använd dig av idealgaslagen pV=nRT, eller pV=NkT, som fysikerna föredrar. Du får då att p/T=konstant.
Smaragdalena skrev:Repetition av Fy1 och Ke1: Använd dig av idealgaslagen pV=nRT, eller pV=NkT, som fysikerna föredrar. Du får då att p/T=konstant.
Nu är jag lite förvirrad, är det inte V som är konstant?
Volymen är konstant, allmänna gaskonstanten (alternativt Bolzmanns konstant) är konstant, mängden gas är konstant. Alltså gäller att
Smaragdalena skrev:Volymen är konstant, allmänna gaskonstanten (alternativt Bolzmanns konstant) är konstant, mängden gas är konstant. Alltså gäller att
Nu fått jag rätt svar, men vill dubbelkolla om jag har använt mig rätt metod?
Ja, men om du vill ha trycket i atm är det onödigt att räkna om det till Pa och tillbaka. Du har att oberonde av vilken enhet du har för trycket.
Smaragdalena skrev:Ja, men om du vill ha trycket i atm är det onödigt att räkna om det till Pa och tillbaka. Du har att oberonde av vilken enhet du har för trycket.
Åh juste👍🏼