Aktiveringsenergi (Kenitik)
Hej!
Jag undrar varför en reaktion som kräver mer aktiveringsenergi går snabbare än en reaktion som kräver mindre aktiveringsenergi? Borde reaktionen som kräver mindre aktiveringsenergi inte gå fortare eftersom att det inte krävs så mycket energi för att reaktionen ska sätta igång?
Tack på förhand!
En reaktion som kräver lägre aktiveringsenergi kommer gå snabbare. Se Arrhenius ekvation!
Ja, jag tänkte väll det! Då måste jag ha missuppfattat det jag hörde i filmen!
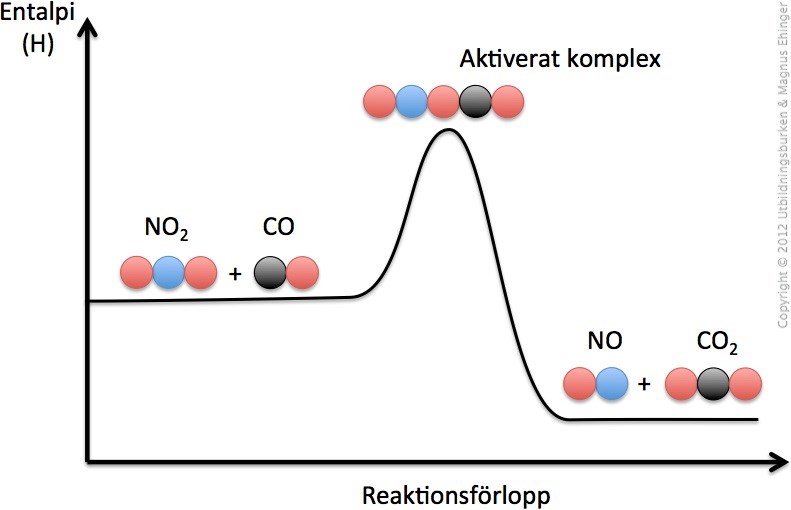
Men visst är de så att om det krävs mer energi till att bilda en reaktion än energin som avges vid reaktionen så är det en endoterm reaktion, medan om det krävs mindre energi att bilda reaktionen men släpps mer energi när reaktionen är skedd så är de en exoterm reaktion?
”Bilda en reaktion” - menar du ”bilda ett aktiverat komplex”? Kan vara så, men inte nödvändigtvis.
När jag säger så, så menar jag när två ämnen reagerar med varandra. Alltså den energin som krävs för att 2 ämnen ska reagera.
Förstår du vad jag menar? (:
Ja, det kallas för aktiverat komplex, dvs den instabila förening man får högst upp i energidiagrammet när man har tillfört all aktiveringsenergi.
Är det detta som jag skrev i #3 som kallas för aktivera komplex?
"Men visst är de så att om det krävs mer energi till att bilda en reaktion än energin som avges vid reaktionen så är det en endoterm reaktion, medan om det krävs mindre energi att bilda reaktionen men släpps mer energi när reaktionen är skedd så är de en exoterm reaktion?"