Aktivieringsenergi
Hej
Det står i min bok att det krävs 436 kJ/mol för att bryta bindningen i H2 och det krävs 151 kJ/mol för att bryta bindningen i I2 och när det aktiverade komplexet H2I2 sönderfaller till HI frigörs 598 kJ. Vilket innebär att reaktionen är svagt exoterm.
Det står också att det krävs en aktiveringsenergi utöver partiklarnas medelenergi och denna aktiveringsenergi behövs för att försvaga vissa bindningar hos reaktanter och det är därför det ativerade komplexet har en högre energi än de reaktanternas medelenergi och entalpin ser så här ut: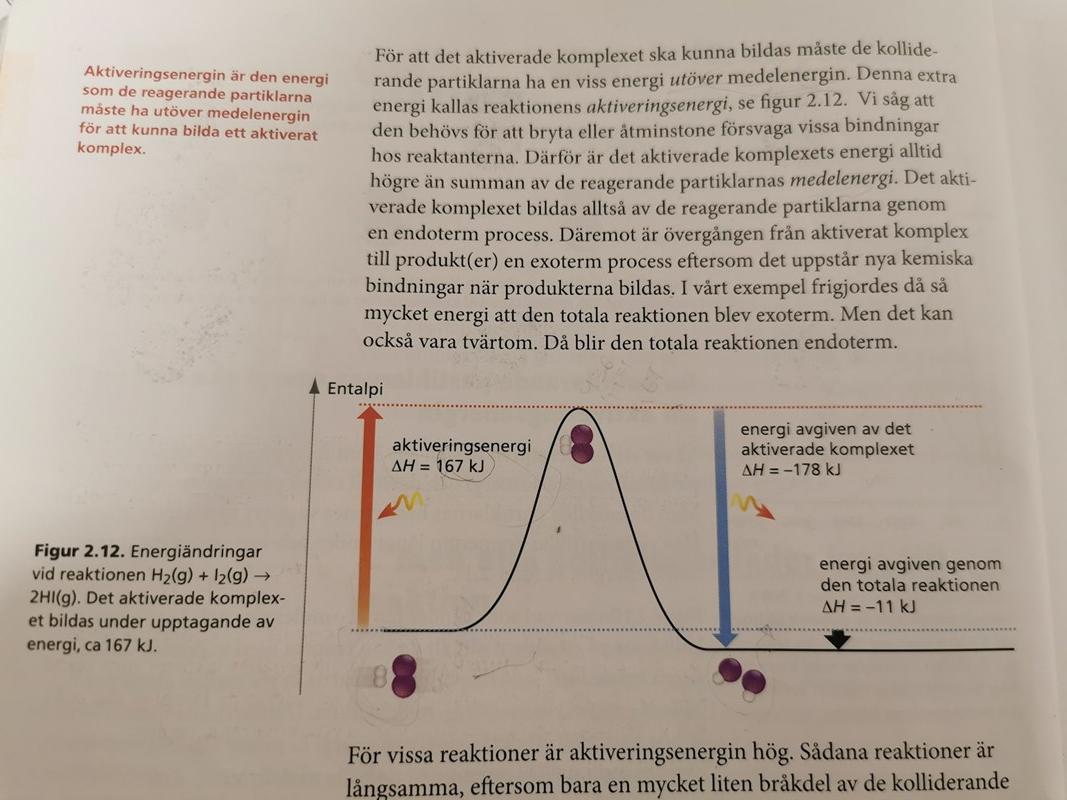
Jag fattar inte om aktiveringsenergin är samma sak som energin som behövdes för att bryta bindningarna eller ej och ifall det är så varför är det inte lika med 436+151? Är energin som behövs för att reaktionen ska ske aktiveringsenergi + energin för att bindningar bryts?
Blir tacksam om någon hjälper mig
Varifrån kommer siffrorna 436 och 151? Vilken enhet?
Smaragdalena skrev:Varifrån kommer siffrorna 436 och 151? Vilken enhet?
Det står att det krävs 436 kJ/mol för att bryta bindningen i H2 och det krävs 151 kJ för att bryta bindningen i I2.
Det står så:

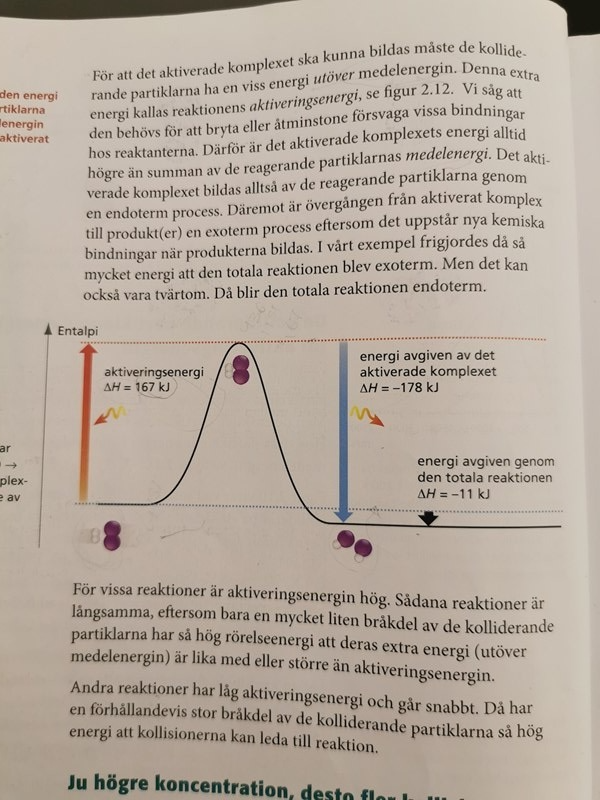
Det är två olika sätt att tänka. Antingen plockar man sönder 1 vätgasmolekyl och 1 jodmolekyl till två väteatomer och två jodatomer (det går åt 587 kJ/mol) och låter atomerna reagera med varandra så att det bildas vätejodid (då frigörs det 598 kJ), totalt har det frigjorts 11 kJ/mol. Eller så tillför man 167 kJ till 1 mol vätgas och 1 mol jodånga, så att det bildas ett aktiverat komplex, och därefter sönderfaller det aktiverade komplexet och avger 178 kJ medan det bildas 2 mol HI, totalt har det frigjorts 11 kJ/mol.
Smaragdalena skrev:Det är två olika sätt att tänka. Antingen plockar man sönder 1 vätgasmolekyl och 1 jodmolekyl till två väteatomer och två jodatomer (det går åt 587 kJ/mol) och låter atomerna reagera med varandra så att det bildas vätejodid (då frigörs det 598 kJ), totalt har det frigjorts 11 kJ/mol. Eller så tillför man 167 kJ till 1 mol vätgas och 1 mol jodånga, så att det bildas ett aktiverat komplex, och därefter sönderfaller det aktiverade komplexet och avger 178 kJ medan det bildas 2 mol HI, totalt har det frigjorts 11 kJ/mol.
Nu förstår jag men vad menas med att det aktiverade komplexets energi alltid är högre än summan av de reagerande partiklarnas medelenergi?
Vad är partiklarnas medelenergi?
Tack så mycket för hjälpen
Partiklarnas medelenergi är ett mått på temperaturen. Ju högre temperatur, desto högre är partiklarnas medelenergi. Det finns alltid en del partiklar som rör sig snabbare och en del som rör sig långsammare.


