Koncentrationen av kalciumjoner och saltsyra
Hej! Jag har en uppgift i analytisk kemi som jag måste lämna in idag.
Med hjälp av en katjonbytare ville man bestämma koncentrationen av kalciumjoner
i en kalciumkloridlösning som också innehöll saltsyra, HCl (aq).
Man tog ut två prov från denna lösning. Prov 1 som var på 20,00 cm3 titrerades med
0,1010 mol/dm3 NaOH. Det gick åt 9,50 cm3 natriumhydroxidlösning för neutralisation.
Prov 2 var på 10,00 cm3 och detta prov lät man rinna genom en jonbytarkolonn som
innehöll vätejonmättad katjonbytare. Lösningen samlades upp i en E-kolv. Man lät
sedan destillerat vatten passera genom kolonnen och samlade också upp detta vatten i
kolven.
Lösningen i E-kolven titrerades som förut med 0,1010 mol/dm3 NaOH. Denna gång gick
det åt 22,50 cm3 natriumhydroxidlösning. Beräkna koncentrationen av saltsyra och
koncentrationen av Ca2+ i kalciumkloridlösningen.
Jag räknade ut koncentrationen för HCL i prov 1. men jag vet inte hur ska jag fortsätta, kan nån hjälpa mig?
Kom ihåg HCl, inte HCL.
Hur ser dina uträkningar ut?
Jag tänkte att för neutralisationen i prov 1 så är substansmängden HCl = substansmängden NaOH vid ekvivalenspunkten.
n(NaOH)= c*V= 0,0101*9,5*10^-3 = 9,595*10^-4 mol
c(HCl)= n/V= (9,595*10^-4)/(20*10^-3)= 0,04798 mol/dm3
men vet inte vad jag ska göra sen
Pikkart skrev:Kom ihåg HCl, inte HCL.
Hur ser dina uträkningar ut?
Jag tänkte att för neutralisationen i prov 1 så är substansmängden HCl = substansmängden NaOH vid ekvivalenspunkten.
n(NaOH)= c*V= 0,0101*9,5*10^-3 = 9,595*10^-4 mol
c(HCl)= n/V= (9,595*10^-4)/(20*10^-3)= 0,04798 mol/dm3
men vet inte vad jag ska göra sen
Rubriken utbytt. Läs igenom reglerna, annars kommer framtida trådar att tas bort eller låsas.
/Mod

Det är givet att katjonbytare består av vätejoner - dvs. alla Ca2+-joner kommer att byta plats mot vätejoner. Hjälper det dig vidare?
Hint: Du kommer att få en surare lösning, den koncentrationsökning av vätejoner du får kommer att motsvara [Ca2+]. OBS. Tänk på molförhållandet i katjonbytet.
Pikkart skrev:Det är givet att katjonbytare består av vätejoner - dvs. alla Ca2+-joner kommer att byta plats mot vätejoner. Hjälper det dig vidare?
Hint: Du kommer att få en surare lösning, den koncentrationsökning av vätejoner du får kommer att motsvara [Ca2+]. OBS. Tänk på molförhållandet i katjonbytet.
jag tänkte att eftersom lösningen innehåller redan vätejoner så kommer inte lika med vätejoner att vandra från jonbytaren till kalciumlösningen.
nu räknar jag koncentrationen H3O+ i prov 2, men vad motsvarar detta då? här är bild på beräkningen
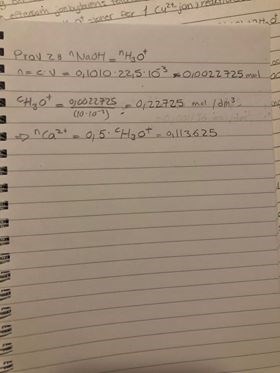
Det är bra att du har tänket kring kemin i resonemanget! Det appliceras inte i den här uppgiften dock!
Du får tänka på vilken jon som har högst affinitet (dragningskraft) till katjonbytaren. Man får komma ihåg att en katjonbytare har bundna partiklar som är negativt laddade. Kalciumjonen har en +2-laddning och kommer att vara mer attraherad till att binda in till katjonbytaren än vad vätejonen (+1-laddning) kommer att vara. Det kommer att resultera i att alla kalciumjoner kommer att binda in till katjonbytaren.
Tänk så här , dvs. det bildas två mol H+ för varje mol Ca2+ som binder in.
Kolla min illustrativa bild för det, du får ursäkta designen - slängde ihop den hastigt i word.

Pikkart skrev:Det är bra att du har tänket kring kemin i resonemanget! Det appliceras inte i den här uppgiften dock!
Du får tänka på vilken jon som har högst affinitet (dragningskraft) till katjonbytaren. Man får komma ihåg att en katjonbytare har bundna partiklar som är negativt laddade. Kalciumjonen har en +2-laddning och kommer att vara mer attraherad till att binda in till katjonbytaren än vad vätejonen (+1-laddning) kommer att vara. Det kommer att resultera i att alla kalciumjoner kommer att binda in till katjonbytaren.
Tänk så här , dvs. det bildas två mol H+ för varje mol Ca2+ som binder in.
Kolla min illustrativa bild för det, du får ursäkta designen - slängde ihop den hastigt i word.
är beräkningen jag gjorde rätt då i detta fall?
På prov 1, vad är sambandet mellan [H+] och pH?
Prov 2: Du använder halva volymen, dvs. 0.04798 M * 10 mL =4.798*10-4 mol H+
Den substansmängd H+ som kom från katjonbytaren är alltså;
22.725*10-4 mol - 4.798*10-4 mol = 17.927*10-4 mol
Nu får du kolla på molförhållandet mellan Ca2+ och H+.
Pikkart skrev:På prov 1, vad är sambandet mellan [H+] och pH?
Prov 2: Du använder halva volymen, dvs. 0.04798 M * 10 mL =4.798*10-4 mol H+
Den substansmängd H+ som kom från katjonbytaren är alltså;
22.725*10-4 mol - 4.798*10-4 mol = 17.927*10-4 mol
Nu får du kolla på molförhållandet mellan Ca2+ och H+.
Här är hela lösningen och svar jag kom fram till, stämmer det nu?

Ser rätt ut med uträkningarna men du har ett slarvfel (kolla om du kan hitta det), som inte påverkar uträkningen men påverkar resonemanget.
Obs. Inte gjort en kontrollräkning utan förutsätter att du knappat rätt på räknaren.
Ps. Förstår du vad det är du räknar på och varför?
Lite konstigt att man inte nämnde att jonbytaren är laddad med just oxoniumjoner. Mina föräldrar hade i många år en jonbytaranläggning som bytte de "hårda" jonerna i deras brunnsvatten mot natriumjoner.
Pikkart skrev:Ser rätt ut med uträkningarna men du har ett slarvfel (kolla om du kan hitta det), som inte påverkar uträkningen men påverkar resonemanget.
Obs. Inte gjort en kontrollräkning utan förutsätter att du knappat rätt på räknaren.
Ps. Förstår du vad det är du räknar på och varför?
Ja, jag räknade ju substansmängden vätejoner före och efter jonbytet för att sen kunna räkna ut subs.mängden av vätejonerna kom från katjonbytaren (Då det redan fanns vätejoner i lösningen).
Sen vet man att den totala laddningen för jonbytet ska vara noll, därför vandrar 2st vätejoner från jonbytaren till lösningen för varje kalciumjon som vandrar från lösningen till jonbytaren.
Men kan inte hitta slarvfelet jag gjorde, men vill gärna veta det för att förbättra mig själv :) !!
Smaragdalena skrev:Lite konstigt att man inte nämnde att jonbytaren är laddad med just oxoniumjoner. Mina föräldrar hade i många år en jonbytaranläggning som bytte de "hårda" jonerna i deras brunnsvatten mot natriumjoner.
Då antar jag kanske att deras jonbytare var en katjonbytare med natriumjoner som katjoner (motjoner).
Pikkart skrev:Ser rätt ut med uträkningarna men du har ett slarvfel (kolla om du kan hitta det), som inte påverkar uträkningen men påverkar resonemanget.
Obs. Inte gjort en kontrollräkning utan förutsätter att du knappat rätt på räknaren.
Ps. Förstår du vad det är du räknar på och varför?
Nu tänkte jag lite till, är det att jag inte nämnde att cHCl=cH3O+ ? Men eftersom protolysgraden är 100% så påverkade det inte beräkningen
Du skriver att istället för .
Pikkart skrev:Du skriver att istället för .
Såg det nu!! Fixar direkt, är så tacksam för din hjälp :)




