Analys av KIO3 genom rektion med I- i sur lösning och tiltrering med Na2S2O3
Hej, jag ska göra en labb (första labben ever i universitetet whoho!), den heter som rubriken lyder. Vi har fått ett informationsblad om själva labben, redan första meningen förstår jag ingenting av:
IO3- är ett oxidationsmedel som oxiderar I- till I2 i sur lösning varvid jodatjonerna själva reduceras till I2. Om jodid finns i överskott reagerar den bildade joden med jodidjonerna och trijodidjoner I3- bildas.
I- jonen ska komma från saltet KI, det har jag lyckats ta reda på. På en annan del av sidan står denna reaktionsformel: IO3- + I- + H+---> I3- + H2O, beskriver denna reaktionsformeln från första meningen i citatet?
I- oxideras till I2 och IO3- reduceras till I2, allt blir I2?!
Den andra meningen förstår jag inte heller. Kan jag omformulera den till "Om jodidjoner finns i överskott reagerar den med sig själv och bildar I3-"? Eller reagerar I- och I2 för att bilda I3-? Det låter rimligare. Jag är ganska säker på att det är så det går till när I3- bildas, men varför står det då att jodidjonen reagerar med jodidjoner?
Tack på förhand,
en högst förvirrad elev
beskriver denna reaktionsformeln från första meningen i citatet?
Den sammanfattar båda meningarna. Man skulle rent principiellt dela upp reaktionen i två delsteg:
jodat + jodid —> molekylärt jod
molekylärt jod + jodid —> trijodid
(där du får komplettera med vatten, vätejoner osv)
Jod är lite speciellt i bemärkelsen att dess joner kan reagera med molekylärt jod och bilda nya typer av jodjoner som trijodid och pentajodid. Man ser inte det på samma sätt hos andra halogener som fluor och klor.
Är K+ jonen i KI relevant alls?
jodat + jodid —> molekylärt jod
molekylärt jod + jodid —> trijodid
Ahh... okej, tack. Det där påminner om en syra som avger H+ två gånger, som H2SO4. Eller liksom att två reaktioner händer efter varandra men ändå samtidigt och fram och tillbaka eller nåt sånt.
Nu ska jag läsa vidare, ska jag göra en ny tråd om något nytt dyker upp (som kommer hända inom mycket snar framtid)?
EDIT: jag märkte först nu att jag läste "den bildade joden" som "den bildade jodiden", dumma mig
Är K+ jonen i KI relevant alls?
Nej, inte relevant för reaktionen. En åskådarjon (som oftast med alkalimetallernas joner, dvs).
Det här är ett praktexempel på varför jag förespråkar halvcellsmetoden vid balansering av redoxreaktioner. Det blir mycket tydligare (enligt min mening) om man delar upp det i två halvceller - oxidation av jodid och reduktion av jodat, som man sedan lägger ihop och förenklar. Annars kan det lätt bli rörigt när det vid både oxidation och reduktion bildas samma ämne.
Nu ska jag läsa vidare, ska jag göra en ny tråd om något nytt dyker upp (som kommer hända inom mycket snar framtid)?
Fortsätt här om den nya frågan är en följdfråga på detta eller om det hör ihop med labben.
Det här är ett praktexempel på varför jag förespråkar halvcellsmetoden vid balansering av redoxreaktioner. Det blir mycket tydligare (enligt min mening) om man delar upp det i två halvceller - oxidation av jodid och reduktion av jodat, som man sedan lägger ihop och förenklar. Annars kan det lätt bli rörigt när det vid både oxidation och reduktion bildas samma ämne.
Och jag håller inte alls med! Jag föredrar oxidationstalsmetoden i alla lägen, så att man sliper hålla på med något så litet som elektroner.
Åskådarjon, mycket passande terminologi haha.
Jag förstår inte riktigt vad du menar men jag gör i alla fall såhär och det känns bra 
-------------------------- Följdfråga:
Redan nästa stycke förstår jag inte.
De bildade trijodidjonerna titreras med tiosulfat S2O32- som oxideras till tetrationat S4O62- och allt I2 (i form av trijodidjoner) reduceras till I-. Från antalet mol S2O32- som förbrukas vid titreringen beräknas antalet mol IO3-.
Jag tänker att om detta händer
jodat + jodid —> molekylärt jod
molekylärt jod + jodid —> trijodid
Så är det någon sorts jämvikt mellan jodat jodid jod och trijodid (det kanske inte finns någon jodat eftersom de pratar om ett överskott av jodid?)?
Jag förstår inte vad som reduceras till I-. Vad betyder "allt I2 (i form av trijodidjoner)"?! I2 och trijodidjoner är två olika ämnen! Reduceras både I2 och I3- till I-?
Smaragdalena skrev:Det här är ett praktexempel på varför jag förespråkar halvcellsmetoden vid balansering av redoxreaktioner. Det blir mycket tydligare (enligt min mening) om man delar upp det i två halvceller - oxidation av jodid och reduktion av jodat, som man sedan lägger ihop och förenklar. Annars kan det lätt bli rörigt när det vid både oxidation och reduktion bildas samma ämne.
Och jag håller inte alls med! Jag föredrar oxidationstalsmetoden i alla lägen, så att man sliper hålla på med något så litet som elektroner.
Tills du ska ställa upp halvcellspotentialer med Nernsts ekvation utifrån reaktionen och behöver veta hur många elektroner som förflyttas i reaktionen :)
Jag förstår inte riktigt vad du menar men jag gör i alla fall såhär och det känns bra
[bild]
Ja, men du ser! Där står det till och med att du ska använda halvcellsmetoden (half equation = halvcell eller delförlopp på svenska). Den metoden är i princip praxis på universitetet medan oxidationstalsmetoden dominerar på gymnasiet. Jag tror att det just beror på att man behöver räkna på reaktionerna i högre grad på universitetet och då är halvcellsmetoden (som nämnt i föregående inlägg) enklare.
Så är det någon sorts jämvikt mellan jodat jodid jod och trijodid (det kanske inte finns någon jodat eftersom de pratar om ett överskott av jodid?)?
Jag förstår inte vad som reduceras till I-. Vad betyder "allt I2 (i form av trijodidjoner)"?! I2 och trijodidjoner är två olika ämnen! Reduceras både I2 och I3- till I-?
Först är det jodatjoner som oxiderar jodidjoner där båda bildar molekylärt jod (I2). Om man hade jodidjonerna i överskott kommer de att reagera vidare med I2 och bilda trijodidjoner. Det är dessa som ger en blå färg om man tillsätter stärkelse till en jodlösning.
Om man sedan tillsätter tiosulfat kommer de i sin tur att reducera tillbaka trijodid till jodidjoner som man hade från början.
Vitsen med det hela är att tillsätta jodidjoner i överskott från början så att alla jodatjoner förbrukas. Tillsätter man stärkelse får då lösningen en blålila färg. Tillsätter man nu tiosulfat kommer lösningen att avfärgas och bli färglös när alla jodmolekyler har reducerats tillbaka till jodidjoner. Man kan beräkna hur många mol tiosulfat som tillsattes och hur många mol molekylärt jod som det i så fall har reagerat med. Detta motsvarar mängden jod som bildades i den första reaktionen. Utifrån den kan man sedan räkna ut hur många mol jodatjoner som fanns från början. Hänger du med?
...så att alla jodatjoner förbrukas.
Ingen jämvikt alltså? Ingen jämvikt någonstans?
Ja tack för att du använder ordet tillbaka, bara det lilla gör allt väldigt mycket tydligare.
Stärkelsen tillsätts alltså innan tiosulfaten, det var en viktig poäng som jag missade, så att man har något att kolla efter (ingen färg).
I2+sträkelse=färg? I3-+stärkelse=färg? I-+sträkelse=ingen färg?
n(tiosulfat som användes)=n(vadå)?
Qetsiyah skrev:...så att alla jodatjoner förbrukas.
Ingen jämvikt alltså? Ingen jämvikt någonstans?
Ja tack för att du använder ordet tillbaka, bara det lilla gör allt väldigt mycket tydligare.
Stärkelsen tillsätts alltså innan tiosulfaten, det var en viktig poäng som jag missade, så att man har något att kolla efter (ingen färg).
I2+sträkelse=färg? I3-+stärkelse=färg? I-+sträkelse=ingen färg?
Första steget med jodat och jodid är inte en jämvikt, eller i alla fall en försumbar jämvikt. Likaså reaktionen mellan tiosulfat och trijodid. Det finns en jämvikt mellan jodid, molekylärt jod och trijodid. Det spelar dock ingen roll eftersom allt molekylärt jod till slut helt omvandlas till trijodid i takt med att du titrerar bort trijodid med tiosulfat (le Chateliers princip). Du kan ignorera jämvikter helt i den här uppgiften.
Problemet med jodmolekyler är att de är opolära och därför är jod svårlösligt i vatten. Om det finns jodidjoner i vattnet kan dock dessa reagera med jodmolekylerna och bilda (laddade) trijodidjoner, som ju lätt kan lösas i vatten. Man kan alltså inte lösa upp så mycket jod i vanligt vatten, vilket innebär att det inte sker något kraftigt färgomslag vid tillsats av stärkelse som det däremot gör om man tillsätter det till en trijodidlösning. Det är själva trijodidjonerna som binder till stärkelsemolekylerna (amylos) och bildar ett starkt blålila-färgat komplex. Tillsätter man stärkelse till en lösning med enbart jodidjoner sker inget färgomslag alls och då förblir lösningen färglös/transparent.
Qetsiyah skrev:n(tiosulfat som användes)=n(vadå)?
När du har en balanserad reaktionsformel för titreringen kan du räkna ut hur många mol trijodid du har förbrukat. Du måste alltså titta på ekvivalensförhållandet mellan dem i formeln, precis som vid en vanlig syrabastitrering.
God morgon!
Jag förstår fortfarande inte riktigt hur lösningen blir färglös. Tiosulfaten oxiderar alltså I3- till I- vilket är färglöst. Inget I2 "kommer undan" eftersom I2 reagerar med överskottet av I- och bildar I3- vilken oxideras till I-. Reagerar inte tiosulfat med I2 alls?
Vid titreringens slut finns inget I2 kvar i titranden (pga la chatelier)? JA?
Vid titreringens slut finns inget I3- i titranden? JA!!!
Finns det något I- i titranden innan man börjar titrera? JA?
Finns det något I- i titranden efter titreringens slut? JA!!!
Man kan beräkna hur många mol tiosulfat som tillsattes och hur många mol molekylärt jod som det i så fall har reagerat med. Detta motsvarar mängden jod som bildades i den första reaktionen
...vilken inte var en jämvikt? Ah!
Vid reaktion mellan jodat och jodid bildas molekylärt jod. Detta är svårlösligt i vatten och fälls ut ur lösningen ifall det bildas tillräckligt mycket av det. Då finns följande jämvikt:
Tanken är ju att man ska använda titrering för att ta reda på hur mycket molekylärt jod som har bildats, men det är opraktiskt i detta läge eftersom 1) mycket jod har fällts ut ur lösningen, 2) man kan inte använda stärkelse som indikator och då blir det svårt att veta när man har nått ekvivalenspunkten.
Om man har ett överskott av jodid från första början säkerställer man att 1) alla jodatjoner har förbrukats och bildar molekylärt jod (viktigt eftersom man vill veta hur mycket jodat som fanns i provet) samt 2) jodmolekylerna reagerar med jodidjoner för att bilda trijodid.
Fördelen med att ha trijodidjoner istället för jodmolekyler är att 1) trijodidjonerna bildar färggranna komplex med stärkelse som då kan användas som indikator vid titrering samt 2) allt utfällt molekylärt jod går i lösning igen eftersom följande jämvikt existerar:
Har man ett stort överskott av jodid ligger jämvikten långt åt höger och man kanske inte ens ser någon fällning av molekylärt jod. Om inte all jod löses upp kommer den ändå att försvinna under titreringen då man förbrukar trijodid. Le Chateliers princip säger att jämvikten förskjuts åt höger när man plockar bort trijodidjonerna och då förbrukas allt molekylärt jod.
Ekvivalensförhållandet mellan molekylärt jod och trijodid är 1:1, vilket innebär att det ursprungligen bildades lika många mol molekylärt jod som antalet mol trijodid man titrerade bort. Att man har tridjodid istället för molekylärt jod i titranden är alltså bara något som underlättar titreringen rent praktiskt.
Kan också tillägga att alla reaktioner är jämvikter teoretiskt sett, även reaktioner som man oftast behandlar som enkelriktade (protolys av starka syror t.ex.). Detta i meningen att man kan beräkna en jämviktskonstant för alla typer av reaktioner. I vissa fall är den dock så absurt liten eller absurt stor att det kanske bara finns några enstaka molekyler av ett ämne vid jämvikt. Det är inte ens mätbart, så är det ändå relevant att prata om en jämvikt? Var går gränsen för när vi betraktar en reaktion som en jämvikt? När det finns 100 molekyler, en miljon? En kvadriljon?
Okej. Jag tolkar det som att mina fyra påståenden och svar är sanna. Jag förstår nu, tack. Nu återstår det att planera labben kvantitativt (vi ska väga och bestämma alltihop), får jag fråga frågor om det här i samma tråd?
Kan också tillägga att alla reaktioner är jämvikter teoretiskt sett, även reaktioner som man oftast behandlar som enkelriktade (protolys av starka syror t.ex.). Detta i meningen att man kan beräkna en jämviktskonstant för alla typer av reaktioner. I vissa fall är den dock så absurt liten eller absurt stor att det kanske bara finns några enstaka molekyler av ett ämne vid jämvikt. Det är inte ens mätbart, så är det ändå relevant att prata om en jämvikt? Var går gränsen för när vi betraktar en reaktion som en jämvikt? När det finns 100 molekyler, en miljon? En kvadriljon?
Ja, vår kemilärare berättade också det. En reaktion jag absolut inte kunde tänka mig var en jämvikt var förbränning, men även den var en jämvikt.
får jag fråga frågor om det här i samma tråd?
Ja, absolut!
Vänta... Jodatjonerna kommer aldrig tillbaka? Först oxideras det till I2 och sedan reagerar med I- och bildar I3-, sedan reagerar det med tiosulfat och blir I-, snipp snapp slut så va jodat slut. Det blir i slutändan I- alltså
Summa-ordformel: Jodatjoner + tiosulfatjoner -> jodidjoner + tetrationatjoner.
Vad läser du för utbildning, Qetsiyah? Det verkar inte ha blivit tekninsk fysik.
Okej.
Bioteknik! Jag kom inte in
Hoppas det blir kul med bioteknik! Var läser du? KTH (inbillar mig att du är stockholmare...)?
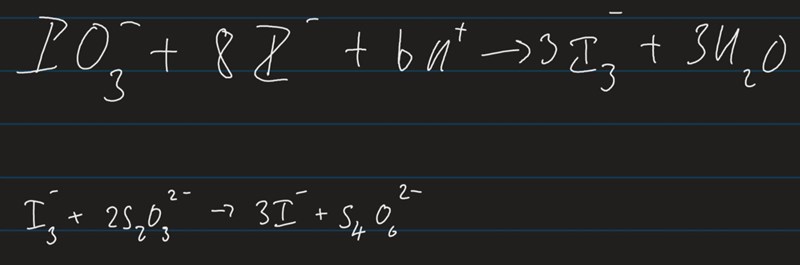 detta är de balanserade formlerna jag får. Hörhållandet mellan jodat:trijodid och det är 1:3, sedan trijodat:tiosulfat är 1:2. ser det rätt ut?
detta är de balanserade formlerna jag får. Hörhållandet mellan jodat:trijodid och det är 1:3, sedan trijodat:tiosulfat är 1:2. ser det rätt ut?
Förresten, I2 verkar inte spela någon roll pga la chatelier (jag skrev av dessa formler från lärare)
n(Tiosulfat)*(1/6)=n(KIO3) right right right?
Smaragdalena skrev:Hoppas det blir kul med bioteknik! Var läser du? KTH (inbillar mig att du är stockholmare...)?
Jag är en stockholmare ja. KTH
Står det ? Handstilen är svårläslig! I ser ut som P och H ser ut som U.
Summaformeln blir då . Jodidjonerna som behövs för att reaktionen skall kunna ske tillbakabildas (plus att det blir en till). Jodmolekylerna bildas och förbrukas omedelbart - så sker det ofta i biologin, något förbrukas så fort det bildas och man behöver inte räkna med jämvikt. Jämvikt är död.




