Atomfysik
Hej! Jag har svårt att tolka bilden. Jag försökte beräkna våglängden 303Å först, med n=1 vilket blev 230Å. Jag tolkade det som att jonisationsgränsen ligger längst till vänster på skalan och att grundtillstånden ligger längst till höger, då kortare våglängder innebär mer energi enligt och då v = c. Det borde innebära att linjen markerad 303Å borde ha n = 1?
Hur vet jag vad som är nollnivå? Är jonisationsgränsen alltid nollnivå?

Dessutom så blir ger n = 1 en energi som är mycket större än joniseringsenergin ER = 13,6 eV. Även fast jag valt fel n borde väl inte formeln ge en energi som är så stor? Hjälp mig bena ut detta problem, tack!
Mycket att packa upp så vi får ta det steg för steg.
HannaKN skrev:Jag försökte beräkna våglängden 303Å först, med n=1 vilket blev 230Å. Jag tolkade det som att jonisationsgränsen ligger längst till vänster på skalan
Det är rätt.
och att grundtillstånden ligger längst till höger [...] Det borde innebära att linjen markerad 303Å borde ha n = 1?
Det är fel. Det står i uppgiften att "De bildar en serie som motsvarar övergångar till grundtillståndet. Alltså motsvarar 303 Å-linjen en energinivå relativt grundtillståndet vilket ger . Om det är eller är en del av vad vi ska undersöka.
Hur vet jag vad som är nollnivå? Är jonisationsgränsen alltid nollnivå?
Det traditionella är att sätta joniseringsnivån till och alltså Energinivån till . Du måste inte men det är så man brukar göra.
Dessutom så blir ger n = 1 en energi som är mycket större än joniseringsenergin ER = 13,6 eV. Även fast jag valt fel n borde väl inte formeln ge en energi som är så stor? Hjälp mig bena ut detta problem, tack!
Tänk på att joniseringsenergin för enkelt joniserat Helium är och alltså fyra gånger så stort som för väte. Du har satt och tagit reda på att motsvarar joniseringsenergin. Detta framkommer direkt av bilden och är inte vad de bett dig göra. Vi skulle alltså ha som följer enligt den enkla modellen:
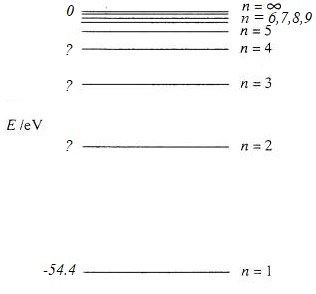
Vilken energi motsvarar 303 Å, 256 Å och 243 Å?

Tillägg: 10 maj 2022 15:38
Jag försökte räkna ut energierna som motsvarade våglängderna du skrev @ebola. Men gjorde det antingen fel eller så blev något annat knasigt på väg mot svaret. Kan du identifiera vart de gick fel?
Du har räknat ut energierna rätt men kanske inte förstått vad de betyder. Spektrumet fås som övergångar till grundtillståndet. Vi kan då beskriva fotonen med våglängd 303 Å som en övergång mellan n=2 och n=1 därför att: