Balansera Formel - Allmän kemi och kemiska energikällor
Hej, denna universitetskurs kanske anses som gymnasienivå så jag ber om ursäkt ifall detta är på fel plats!
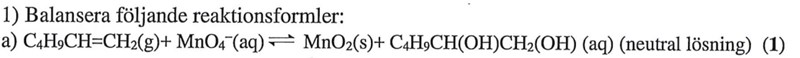
Jag sitter och pluggar inför tentan där jag ska balansera formler och har nu suttit med denna uppgift utan några framsteg. Jag försökte mig på att räkna på oxidationstalen utan lycka och vet inte riktigt hur jag ska hantera dubbelbindingen. All hjälp uppskattas!
Du måste rita strukturen för de två organiska föreningarna och se hur bindningarna sitter, för kolatomerna har olika oxidationstal och det är bara några kolatomer som får ett annorlunda oxidationstal efter reaktionen.
Vi behöver inte bry oss om att det var en dubbelbindning från början, vi kan bara räkna på... Titta bara på de kolatomer där nånting händer. Den yttersta kolatomen binder till två väte och en kol innan reaktionen. En bindning mellan två likadana atomer ger inget bidrag till oxidationstalet, så vi kan räkna med att det kolet har ox.tal -II innan reaktionen. Det andra kolet bilder till tre kol och ett väte, så det ox.talet blir -I. Efter reaktionen binder det yttersta kolet till ett kol, två väte och ett syre, så ox.talet blir 0, och det andra kolet binder till två kol, ett syre och ett väte, så ox.tal +I. Sammanlagd oxidationstalsökning blir 4 steg. Kommer du vidare härifrån?



