Balansera formler
Uppgift:
Ange koefficienterna (minsta möjliga heltal) i följande ofullständiga reaktionsformler:
c)
Jag skrev Det var rätt men jag är inte helt säker på vad det är jag ska göra här. Det handlar om att balansera formlerna har jag förstått, innebär det då att jag skall sätta ut så att det blir jämn elektronfördelning? Samt, vad avgör om det är en Fe (II) eller Fe (III) jon?
eddberlu skrev:Uppgift:
Ange koefficienterna (minsta möjliga heltal) i följande ofullständiga reaktionsformler:
c)
Jag skrev Det var rätt men jag är inte helt säker på vad det är jag ska göra här. Det handlar om att balansera formlerna har jag förstått, innebär det då att jag skall sätta ut så att det blir jämn elektronfördelning? Samt, vad avgör om det är en Fe (II) eller Fe (III) jon?
Vi får räkna på det! Fe3O4 är ett oladdat salt. Summan av alla OT är alltså 0. Fyra stycken syre med OT = -2 vardera ger -8 totalt. De tre järnjonena har alltså sammanlagt en laddning på +8, så det är två med +3 och en med +2. Järnet reduceras alltså sammanlagt 8 steg. Hur många steg oxideras varje kolatom? Hur många kolatomer går det åt? (Du verkar ha haft tur i det här fallet, där det balanserade sig självt.)
Och om du hade lyckats göra den formeln som du har skrivit, alltså förvandla kol och syre till kobolt, så hade du säkert blivit rik! Stora och små bokstäver är jätteviktigt i kemi.
Jag har en till fråga angående detta!
i a) så är formeln
Jag fattar inte hur det kan bli så? Fe är ju 2+ och Cl 1- så det blir ju inte ett oladdat salt alls?
Om ett salt har sammansättningen FeCl3 och man vet att kloridjonen har laddningen -1 så måste järnjonen ha laddningen ..... i den här kemiska föreningen.
+3? Men varför blir den +3 istället för +2? Är det bara så att när det behövs så är Fe (II) eller Fe(III)?
 Betyder detta att det är 2 Kväveatomer, 3 syre och att de tillsammans har laddningen 1- eller att alla tre syreatomerna har 1- per atom?
Betyder detta att det är 2 Kväveatomer, 3 syre och att de tillsammans har laddningen 1- eller att alla tre syreatomerna har 1- per atom?
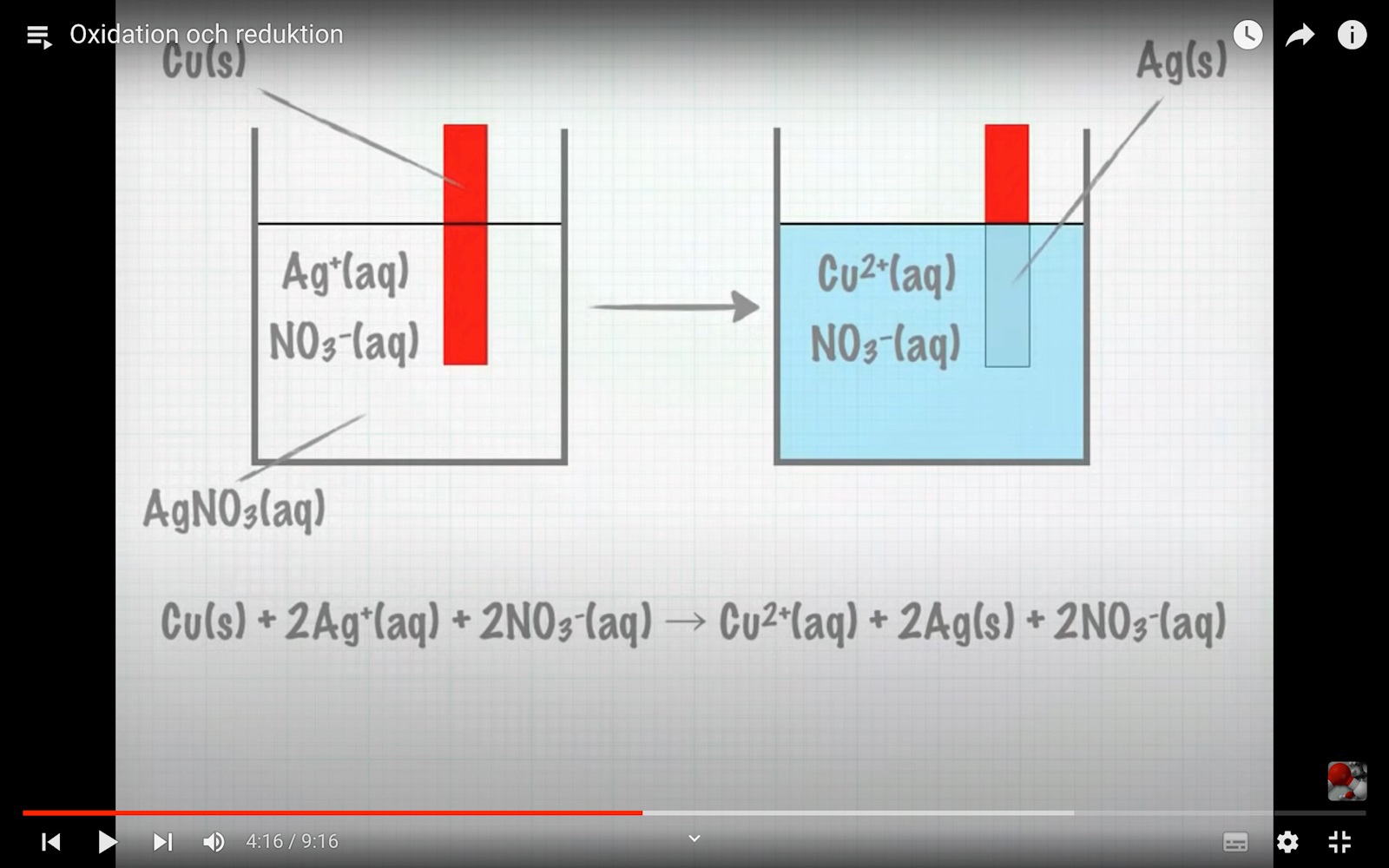 Den här ex. Jag ser inte hur den är balanserad. är ju 6- och Cu + 2Ag är 4+ ??
Den här ex. Jag ser inte hur den är balanserad. är ju 6- och Cu + 2Ag är 4+ ??
eddberlu skrev:+3? Men varför blir den +3 istället för +2? Är det bara så att när det behövs så är Fe (II) eller Fe(III)?
För att annars blir inte FeCl3 ett oladdat salt. Om det hade varit Fe(II) skulle det ha bildats FeCl2 istället.
eddberlu skrev:
Betyder detta att det är 2 Kväveatomer, 3 syre och att de tillsammans har laddningen 1- eller att alla tre syreatomerna har 1- per atom?
Det är två nitraatjoner med laddningen -1 vardera. Varje syre har OT = -II, och eftersom hela jonen har laddningen -1 måste kväveatomen ha OT = .....
+5?
eddberlu skrev:
Den här ex. Jag ser inte hur den är balanserad. är ju 6- och Cu + 2Ag är 4+ ??
Jag anser att åskådarjonen nitratjon inte borde vara med i reaktionsformeln alls. Om vi bortser från de båda nitratjonerna, so har sammanlagd laddning -2 både före och efter reaktionen, så har vi en oladdad kopparatom och två silverjoner med laddning +1 vardera, alltså sammalagt +2 före reaktonen, och en kopparjon med laddningen +2 och två oladdade silveratomer, alltså total laddning +2 efter reaktionen, ingen förändring sammanlagt alltså. Eftersom man har med åskådarjonerna också är laddningen 0 både före och efter reaktionen.
Nu har du frågor om tre olika reaktioner i samma tråd. Det blir väldigt rörigt. Gör en tråd om varje reaktion i fortsättningen, så blir det enklare att svara.
eddberlu skrev:+5?
Vilken av de tre olika reaktionerna i den här tråden syftar du på? Om du menar OT för kväve i nitratjonen så är det korrekt.
Smaragdalena skrev:eddberlu skrev:
Betyder detta att det är 2 Kväveatomer, 3 syre och att de tillsammans har laddningen 1- eller att alla tre syreatomerna har 1- per atom?
Det är två nitraatjoner med laddningen -1 vardera. Varje syre har OT = -II, och eftersom hela jonen har laddningen -1 måste kväveatomen ha OT = .....
Syftade på denna, kväveatomen dvs.
Smaragdalena skrev:eddberlu skrev:
Den här ex. Jag ser inte hur den är balanserad. är ju 6- och Cu + 2Ag är 4+ ??
Jag anser att åskådarjonen nitratjon inte borde vara med i reaktionsformeln alls. Om vi bortser från de båda nitratjonerna, so har sammanlagd laddning -2 både före och efter reaktionen, så har vi en oladdad kopparatom och två silverjoner med laddning +1 vardera, alltså sammalagt +2 före reaktonen, och en kopparjon med laddningen +2 och två oladdade silveratomer, alltså total laddning +2 efter reaktionen, ingen förändring sammanlagt alltså. Eftersom man har med åskådarjonerna också är laddningen 0 både före och efter reaktionen.
Nu har du frågor om tre olika reaktioner i samma tråd. Det blir väldigt rörigt. Gör en tråd om varje reaktion i fortsättningen, så blir det enklare att svara.
Vad menar du med "so har sammanlagd laddning"?
Vad menar du med "som har sammanlagd laddning"?
En nitratjon har laddningen -1, två nitratjoner har laddningen -2 sammanlagt, och så hängde mitt tangentbord inte riktigt med när jag skrev, och jag missade att jag tappat en bokstav.
Okej, jag ska se till att göra olika trådar nästa gång. Att den har 2 + laddning i ena och sedan 2+ laddning i andra känns inte logiskt för mig, varför räcker det? Är det DET som är redoxreaktionen? I mitt huvud är detta bara så ologiskt från vad jag lärde mig i tidigare kapitel. Då handlade det om att balansera, allt skulle vara neutralt. Nu så har vi en negativ jon som observatör och +laddade joner som allt de gjorde var att byta elektroner med varandra och endast 2Ag är oladdat tillslut. VARFÖR ger Kopparn sina elektroner till silver?
eddberlu skrev:Okej, jag ska se till att göra olika trådar nästa gång. Att den har 2 + laddning i ena och sedan 2+ laddning i andra känns inte logiskt för mig, varför räcker det? Är det DET som är redoxreaktionen? I mitt huvud är detta bara så ologiskt från vad jag lärde mig i tidigare kapitel. Då handlade det om att balansera, allt skulle vara neutralt. Nu så har vi en negativ jon som observatör och +laddade joner som allt de gjorde var att byta elektroner med varandra och endast 2Ag är oladdat tillslut.
Vilken "den"?
med "den" menar jag den balanserade formeln. med "ena" menar jag VL och "andra" HL
med "den" menar jag den balanserade formeln. med "ena" menar jag VL och "andra" HL
Vilken formel? Du har tre olika reaktioner i den här stackars tråden. Svara på rätt inlägg, så går det att begripa.
Är det bättre om jag gör en ny istället och överge denna? Mixen av alla blev lite av ett haveri


