Balansera OT
Hej!
Jag håller på och försöker balansera oxidationstal. Jag är på denna:
ClO2 --/--> ClO2 + ClO3
Visst hade Cl i OT -I? Och syre vet man var -II / per O. Visst har jag börjat rätt?
Klor har nästan alltid -I i oxidationstal, men inte när det binder till syre.
Syre är ett av få ämnen som är mer elektronegativt än klor, så den här dragkampen om elektronerna förlorar faktiskt klor.
Har du verkligen skrivit av reaktionsformeln korrekt? Det ser inte ut så i och med att du har ett ämne som bildar sig självt. Har du missat att sätta ut laddningar?
OK, tack så mycket Teraeagle!
Såhär var uppgiften:
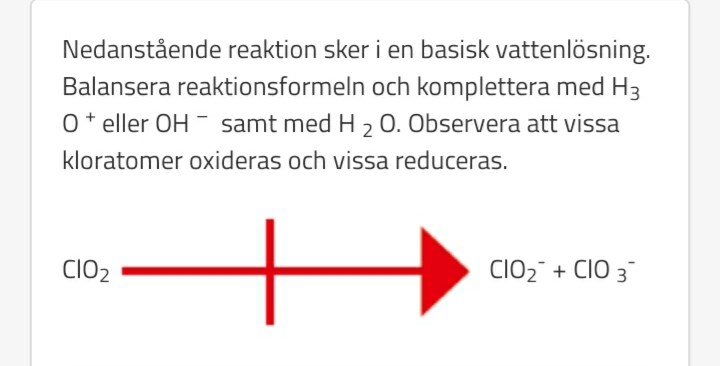
Tycker också denna ser konstig ut (?).
Klor har OT -1 i kloridjoner, men inte i någon av de ämnen du har skrivit. Är det några av ämnena som är joner (inte molekyler)? Klor kan ha många olika oxidationstal från -1 (i kloridjonen) till +6, som i sulfatnonen.
Det där är en typ av reaktion som kallas ”disproportionation” på engelska. I princip är det att ett ämne reagerar med sig självt och bildar två olika produkter där något oxidationstal i den ena produkten blir högre medan det blir lägre i den andra produkten. Kan du sätta ut alla oxidationstal för alla ämnen?
(Här var det som sagt extra viktigt att sätta ut laddningarna)

Är det här rätt? :)
Produkterna är rätt, men inte reaktanten. Nu har du satt att klor har +VIII och syre -II, vilket skulle innebära att hela föreningen har summan +IV i oxidationstal (8+2*(-2)) när det egentligen ska vara 0.
Teraeagle skrev:Produkterna är rätt, men inte reaktanten. Nu har du satt att klor har +VIII och syre -II, vilket skulle innebära att hela föreningen har summan +IV i oxidationstal (8+2*(-2)) när det egentligen ska vara 0.
Oj! -IV och +IV ska det vara!
I nästa steg bör jag kolla om "laddning HL" = "laddning VL", annars sätter jag koefficienter framför så det går jämnt ut. Tack för hjälpen!!
Hur ser det ut när du har balanserat oxidationstalen? Det ger dig koefficienterna för alla de partikelslag som innehåller kloratomer. Dessa skall sedan inte ändras mer. Du kan balansera laddningen i nästa steg, som du föreslår, men genom att lägga till antingen H3O+ eller OH- samt med H2O. Tänk på att reaktionen sker i basisk vattenlösning (det står i ursprungsuppgiften men inte i ditt förstainlägg). Om du har gjort rätt så skall syret stämma. (Jag föredrar att balansera syret och kontrollera laddningen, men ditt sätt går precis lika bra.)




