Balansera redoxreaktion
Behöver lite hjälp med att balansera en redoxreaktion. Suttit med dessa hela uppgifter hela helgen och de går inte ihop för mig...
Blev en bild då formatering ej följer med när man klistrar in här...
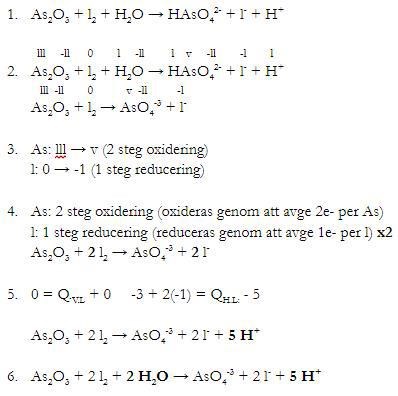
Det som jag är osäker på om jag gjort rätt är när man tar bort åskådarjoner i steg 2. Tar då bort H2O i HL, och H+ i VL och även H i "HAsO4-2" som jag då gör om till "AsO4-3", är detta korrekt? För det ändrar ju hur man räknas i steg 4 och 5? Med H kvar så skulle ju laddning endast bli -4 i HL? Och då kan man väl balansera med 4 H+ i HL som bildar 2 H2O i VL? För som det är nu så har jag behövt balansera med 5 H+ i HL som bildar 2 H2O med en H+ över?
Undrar även om det här med att man ska balansera sur lösning med H+, basisk lösning med OH- och neutral lösning med båda. Hur vet jag om lösningen är sur, basisk eller neutral?
Edit: Vet även att antal atomer är fel men det kommer i senare steg. Även att lägga till åskådarjonerna kommer senare.
Balanseringen As2O3 + 2 I2 ser riktig ut, men hur många AsO43- och I- bildas det på högersidan? Antalet As och antalet I måste stämma, övriga atomslag justerar vi senare.
Det är bra att bara ta med de ämnen som oxideras/reduceras i steg 2. Du borde ha tagit bort vattnet också.
Smaragdalena skrev:Balanseringen As2O3 + 2 I2 ser riktig ut, men hur många AsO43- och I- bildas det på högersidan? Antalet As och antalet I måste stämma, övriga atomslag justerar vi senare.
Det är bra att bara ta med de ämnen som oxideras/reduceras i steg 2. Du borde ha tagit bort vattnet också.
Okej, så jag bör balansera det materialet redan i steg 4? Alltså så här typ?
As2O3 + 2 l2 → 2 AsO4-3 + 4 l-
HL: 2 As, 3 O, 4 l
VL: 2 As, 4 O, 4 l
As och l är då balanserade men O ska balanseras senare? I steg 8 står detta "Kontrollera att antalet syre stämmer både till höger och vänster om reaktionspilen. Balansera generellt materialet (lika antal av grundämnenas atomer på båda sidorna)" så antar att O ska balanseras då?
Förstår inte riktigt vad du menar med att jag borde tagit bort vattnet i Steg 2 också? Det har jag väl gjort här?
As2O3 + l2 → AsO4-3 + l-
Har jag tänkt rätt här?
.jpg?width=800&upscale=false)
Kan du lägga in en bild av uppgiften, alternativt skria av uppgiften ord för ord?
Smaragdalena skrev:Kan du lägga in en bild av uppgiften, alternativt skria av uppgiften ord för ord?
7) Identifiera vad som oxideras och reduceras i föjande reaktion. Balansera reaktionen med avseende på oxidation, laddning och materia.
As2O3 + l2 + H2O --> HAsO42- + l- + H+
Marresmarre01 skrev:Smaragdalena skrev:Kan du lägga in en bild av uppgiften, alternativt skria av uppgiften ord för ord?
7) Identifiera vad som oxideras och reduceras i föjande reaktion. Balansera reaktionen med avseende på oxidation, laddning och materia.
As2O3 + l2 + H2O --> HAsO42- + l- + H+
Aha, du visste att det som bildas är HAsO42-. Det framgick inte av det du skrev i ditt försatinlägg.
Stod det verkligen "l-"? i uppgiften? Det borde stå I-, alltså stora i, inte lilla L.
Smaragdalena skrev:Marresmarre01 skrev:Smaragdalena skrev:Kan du lägga in en bild av uppgiften, alternativt skria av uppgiften ord för ord?
7) Identifiera vad som oxideras och reduceras i föjande reaktion. Balansera reaktionen med avseende på oxidation, laddning och materia.
As2O3 + l2 + H2O --> HAsO42- + l- + H+
Aha, du visste att det som bildas är HAsO42-. Det framgick inte av det du skrev i ditt försatinlägg.
Stod det verkligen "l-"? i uppgiften? Det borde stå I-, alltså stora i, inte lilla L.
Oj mitt fel, stora i "I" for Jod ska det vara. Och HAsO4 ska ha laddning -2. Men i övrigt så är det rätt?
Den balanserade reaktionsformeln är alltså detta? As2O3 + 2 I2 + 5 H2O --> 2 HAsO4-2 + 4 I- + 8 H+
Laddningen är 0 på båda sidorna och materialbalansen verkar stämma?
Om allting stämmer, så är det rätt.


