balansering oxidationstal
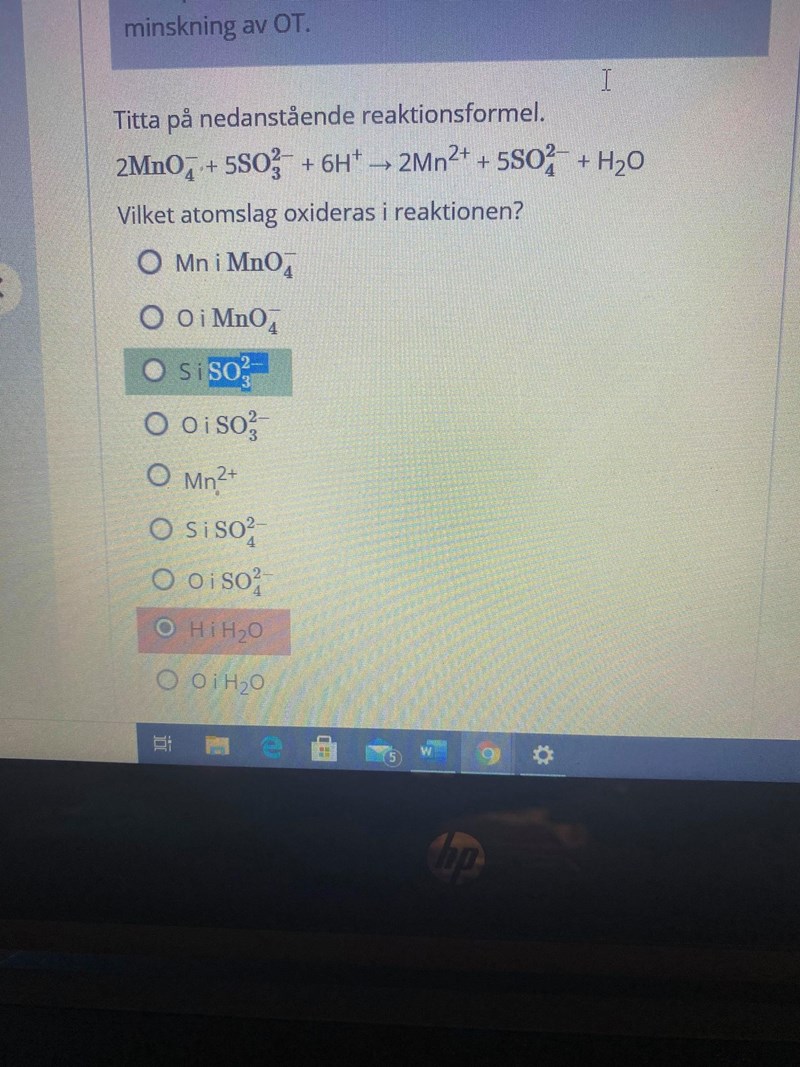
Hej jag har fastnat på ovanstående problem. Förstår inte varför svaret ska vara s och hur man kommer fram till det. Jag har försökt sätta ut oxidationstalen på varje jon ( i och med att det är sammansatta joner i formeln) men kommer ingen ingenstans då båda verkar ha oxiderats , ökat i oxidationstal.
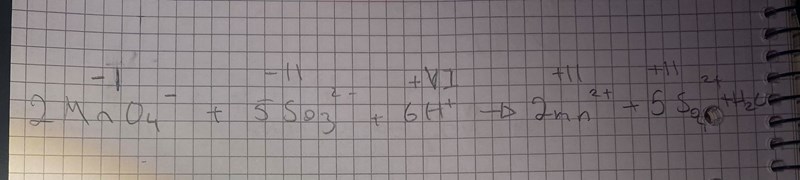
Tacksam för hjälp
Du har fel oxidationstal på alla atomer utom Mn2+. Vis hur du har kommit fram till dem, så kan vi hjälpa dog att hitta vad som har blivit fel. Du kan utgå ifrån att väte har oxidationstalet +I och syre -II i alla sina föreningar.
ja, har kommit fram till dem genom att utgå från att de är sammansatta joner. Borde inte sammansatta joner få oxidationstal efter hela laddningen?
Jo. Vi kan väl börja med att titta på sulfitjonen. Om vi kallar svavels oxidationstal för S så gäller det att S+4(-2) = -2. Vilket värde har S?
s har värdet 6 men visst är sulftijonen , jonen åt höger?


