5
svar
55
visningar
CooltMedKemi är nöjd med hjälpen
Beräkna
Hej!

Jag har börjat med att skriva på pappret:
Kw / [OH^-] = [H3O^+]
Men nu som nästa steg vet jag inte vilka siffror som ska hamna var..
Tack på förhand!
Räkna med att du har 1 liter. Om det finns 0,80 mol HAc och det bildas x mol oxoniumjoner och lika mycket acetatjoner - hur mycket HAc finns det kvar?
Kommer du vidare härifrån?
Smaragdalena, såhär långt har jag kommit:
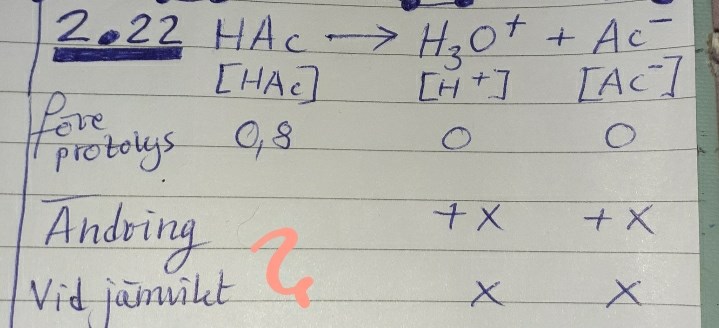
Men nu vet jag inte vad jag borde skriva in under "HAc - vid jämvikt".
Ok, tack!
Visst fortsätter jag såhär? :
Ka= [H3O^+]*[Ac^-] / HAc
1.8 * 10^-5 = x*x / 0.8-x



