Beräkna koefficienten för kristallvattnet
Hej!
Likt ett ev mina tidigare inlägg, försökte jag beräkna koefficienten för kristallvatten i ett salt, denna gången natriumkarbonat. Jag får dock inte till det av någon anledning, gissningsvis för att jag gjort något fel i min ekvationsräkning, men hittar inget som är fel, så kan vara att själva ekvationen jag ställt upp är fel.


Tacksam för all hjälp!
Du har räknat med natriumformiat. I uppgiften är det natriumkarbonat man löst i vatten. Molmassan är alltså fel, även om metoden är rätt.
jahaa, det förklarar saken. Felet berodde på ett fel jag skrivit i mina anteckningar och därav lärt mig fel från början. Tack för hjälpen!
Jag gör fortfarande något fruktansvärt fel.
Du verkar blanda ihop två olika sätt att lösa uppgiften.
Här har du kommit fram till att du avdunstat 0,150 mol vatten från 0,0153 mol natriumkarbonat.
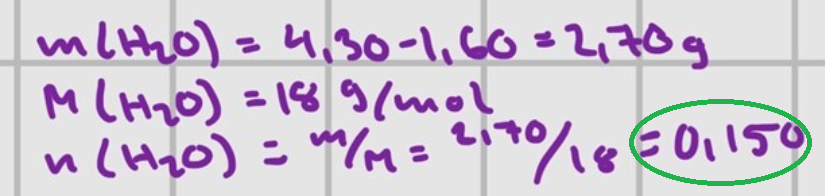
Förhållandet blir 0,150/0,0153≈9,8. Det ser alltså ut som om du har 10 H2O för varje Na2CO3. För varje mol natriumkarbonat har det försvunnit tio mol vatten.
Ett rimligt svar och nu har du löst uppgiften!
Sedan har du ställt upp ekvationen som jag tipsade om i en tidigare fråga. Den bygger på att substansmängden natriumkarbonat är densamma medan molmassan varierar. Det är ett annat sätt att lösa samma problem.

På rektantsidan (VL) tecknar du ett uttryck för antalet mol hydratiserat natriumkarbonat, alltså med kristallvatten. På produktsidan (HL) skall du ha ett uttryck för antalet mol vattenfritt natriumkarbonat. Det är 0,0153 mol, som du räknat ut. Här har vattnet ingenting att göra.
Skippar vi det och löser för x får vi x≈9,8. Samma resultat med en annan metod.
Hängde du med? Fråga annars.
Tror jag hänger med helt, men vill bara förklara hur jag förstått det, så det inte blir något fel igen.
Jag råkade alltså blanda ihop två olika lösningsmetoder, men nedan är de separerade, som de faktiskt ska vara:
Alt.1. När man räknat ut substansmängden för Natriumkarbonaten och vattnet ställer vi sedan upp ett förhållande mellan substansmängderna för att veta hur många vattenmolekyler som "får plats" i 0,0153 mol Natriumkarbonat. Då får vi att x≈9,8 vilket ger oss att koefficienten för mängden vatten ska vara 10.
Alt.2. Följer följande formen som bygger på att substansmängderna är samma, fast med olika molmassor:
x:et finner vi i M för hydratiserat natriumkarbonat som har uttrycket 104,60+18x
På det viset får vi också fram att x≈9,8 vilket ger att koefficienten blir 10.
100% korrekt! Bra förklarat.
Tack snälla för hjälpen!


