Beräkna magnesiumoxids empiriska formel
Hej!
Jo jag har en fråga gällande denna uppgift: Du förbränner 0,99 g magnesium i syre. Då bildas 1,65 g produkt. Beräkna produktens empiriska formel.
Jag har kommit så långt att jag vet syrets massa är 0,66 g, men när det nu kommer till molmassan så förstår jag inte varför molmassan är 16,0 g/mol och inte 32 g/mol. Syre kommer ju alltid två och två så varför tar man inte hänsyn till det här men i andra liknande uppgifter?
Ja precis molekylen syrgas har molmassan 32g/mol.
Och uppgiften är att räkna ut från ett experiment den empiriska formeln, d.v.s. X mol Mg + Y mol O2 => Z mol produkt.
Så om du tittar på antalet mol Mg som du började med, och antalet mol syre och antalet mol magnesium (oförändrat) som det finns i produkten kan du få fram hur många mol syrgas som går åt för att reagera med 1 mol magnesium - d.v.s. molförhållandet och formeln på produkten.
Men om man räknar med hur många mol syrgas det går åt för att reagera med 1 mol magnesium så blir den empiriska formeln Mg2O och det är fel.
Det går inte att kommentera hur du räknat då du inte visat detta. Om du visar hur du räknat kan vi titta på det. Jag får det till något annat.
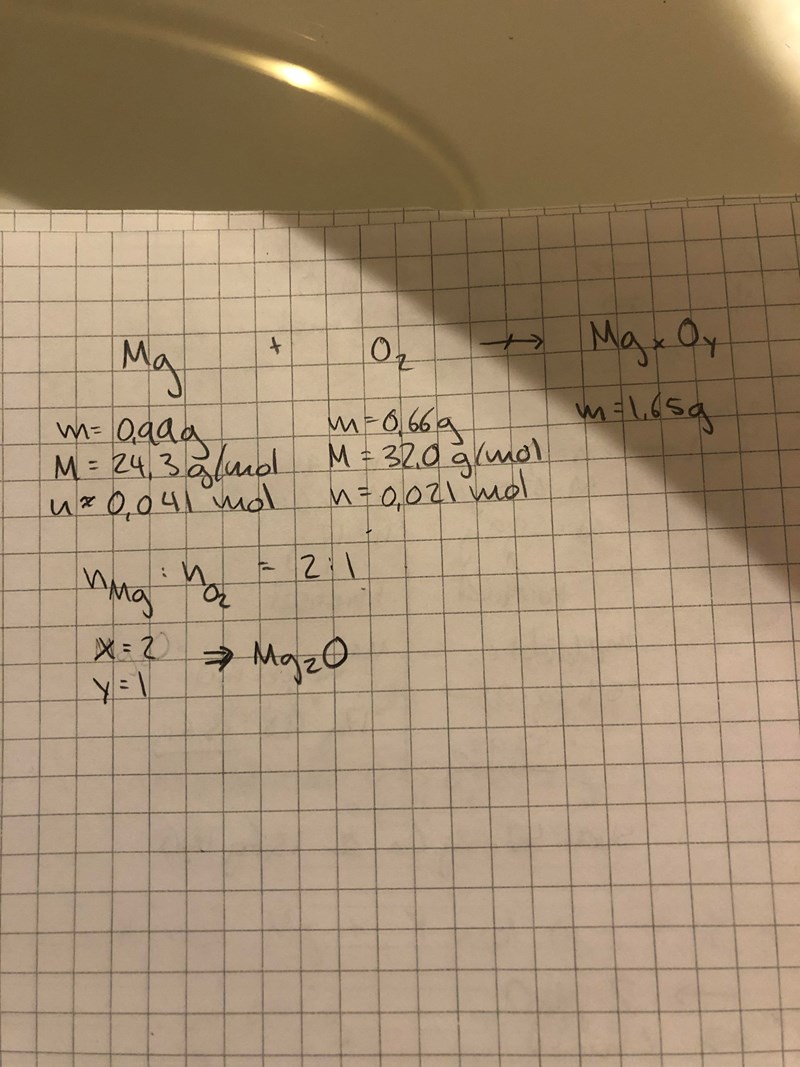 Jag vet att felet ligger i syrets molmassa men förstår inte varför?
Jag vet att felet ligger i syrets molmassa men förstår inte varför?
Den empiriska formeln bryr sig inte om att syret har varit syrgas innan. Det enda som är intressant är hur många mol magnesiumatomer och hur många mol syreatomer det är i produkten. (Om du skall skriva en reaktionsformel behöver du ta hänsyn till att syret fanns i form av syrgas från början.)
Precis som Smaragdalena skrev, och jag försökte antyda spelar det ingen roll i vilken form syret är i för den empiriska formeln av magnesiumoxid.
Du har räknat ut antalet mol syrgas som reagerar, vilket stämmer. Men det du behöver räkna ut för att få den empiriska formeln är antalet mol syre som ingår i produkten.
När du räknat ut antalet mol syre i produkten kan du jämföra denna siffra med antalet mol magnesium, för att på så vis få reda på molförhållandet i produkten (d.v.s. vad x och y är i MgxOy , avrundat till heltal) - och detta blir din empiriska formel av magnesiumoxiden.


