Beräkna pH
Hej jag undrar hur man ska tänka vid en sån här uppgift: Att man blandar 1 mol fosforsyra med 2 mol ammoniak i en liter vatten och sedan ska beräkna pH.
Kan man då tänka så att OH som bildas i basreaktionen reagerar med H30 som bildas i syrareaktionen och sedan bildar vatten. Kan man sedan då tänka att jämvikten förskjuts åt höger i de båda reaktionerna eftersom koncentrationen OH och H30 hela tiden minskar och att detta sker ända tills ammoniaken är slut och då bör rimligtvis 1 M av fosforsyran finnas kvar. Kan man sedan räkna på det som vanligt med syrakonstanten och se det som att man bara har lagt i 1 mol fosforsyra i en lösning?
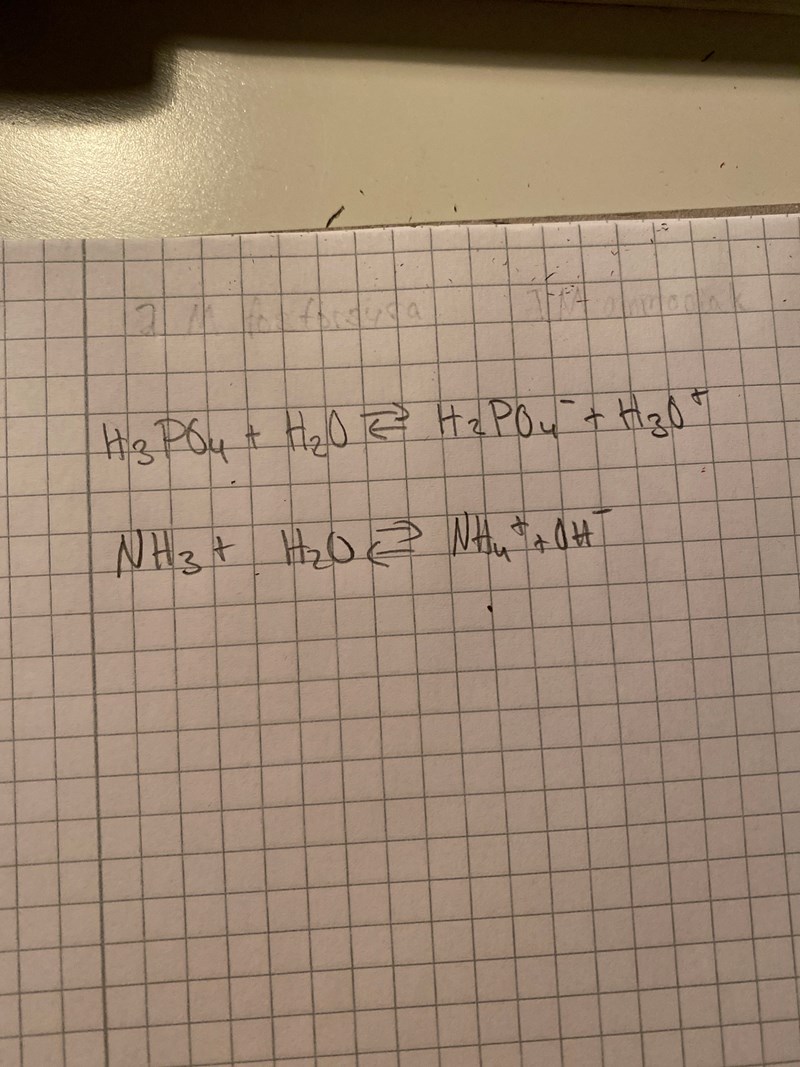
Det där är ett ganska krångligt problem, speciellt om man löser det för hand. Man blandar en svag bas med en svag syra varav syran kan protolyseras i tre steg. Man har hela fyra jämvikter utöver jämvikten för vattens autoprotolys att ta hänsyn till. Det är absolut möjligt att lösa uppgiften, men det är över nivån för kemi 2. Varifrån kommer uppgiften? Det är en ganska typisk uppgift om man läser en kurs i jämviktslära eller akvatisk kemi på universitetet.
Normalt brukar man ställa upp ett ekvationssystem där man samlar olika sorters samband som jämviktsekvationer, haltvillkor, protonvillkor och laddningsvillkor tills man har tillräckligt många ekvationer för att lösa ut koncentrationen av vätejoner och därmed kunna bestämma pH. I vissa fall kan man göra förenklingar och försumma vissa jämvikter, men det är svårt att veta om man kan göra det här också utan att räkna på det mer i detalj.
Jaha okej, jag har inte hittat uppgiften någonstans utan jag började bara tänka själv på hur man skulle kunna räkna i ett sådant fall. :) Och juste jag vet att fosforsyra kan protolyseras i flera steg men ifall vi säger att den endast kan protolyseras i ett steg. Skulle mitt tankesätt vara ungefär rätt då?
Det fungerar inte riktigt så som du har tänkt. Till att börja med kan fosforsyra och ammoniak reagera direkt med varandra i lösningen, de behöver inte gå omvägen via hydroxidjoner och oxoniumjoner för att reagera. Fosforsyra och ammoniak är en syra och en bas som kan reagera direkt med varandra om de stöter på varandra i lösningen i en syrabasreaktion där man får ammoniumjoner och divätefosfatjoner.
För det andra så kan ju reaktionerna fortfarande gå åt bägge håll. Du tycks förutsätta att all fosforsyra reagerar bort och bildar vätefosfatjoner, men så blir inte fallet. De kan reagera åt andra håller igen och bilda divätefosfat, som kan bilda fosforsyra...osv. Det blir som sagt ett ganska komplext system och det är svårt att resonera sig fram till svaret på uppgiften. Man måste lösa det matematiskt...
Ok, jag får helt enkelt acceptera att det är över min nuvarande nivå. Tack ändå för hjälpen! :)


