Beräkna pH (återigen...) från en grafik
Mina aventyrer med kemi fortsätter, utan panash tyvärr.

a) jag skrev (efter några minuter förtvivlan)
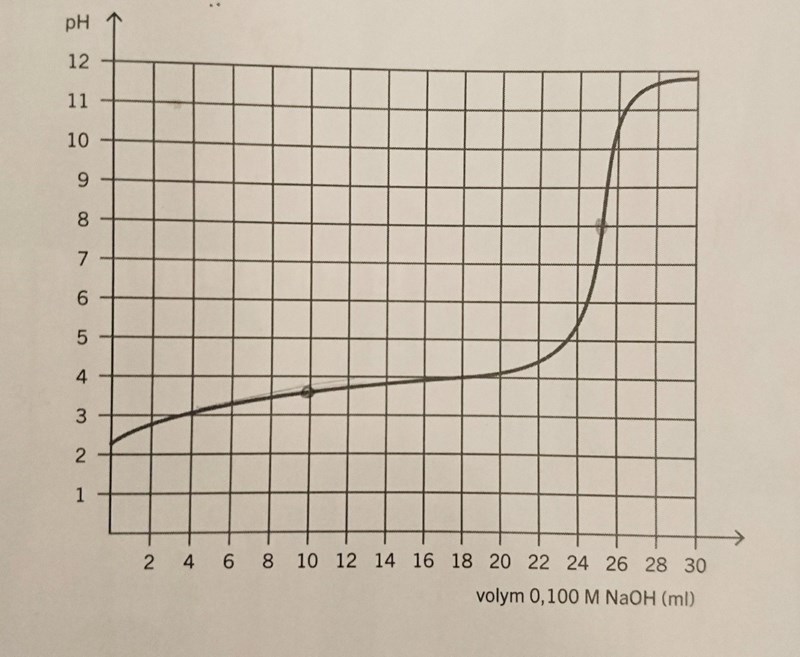
b) vid ekvivalenspunkt har vi c(syra)=c(bas), och man ser på grafiken att pH är då 3,5. Så jag tänkte att , och vidare , dvs 31 ml.
c) jag tog pH 8, när allt myrsyra är neutraliserat, och delat det med 10 kubikcentimeter (allt substansmängden gömde sig väl i dom här 10ml?)
Allt fel såklart...
Det är bara om titratorlösningen har samma koncentration som titranden som man kommer till ekvivalenspunkten nör man har tillsatt lika stor volym titrator som det var titrand från början. Punkten du har markerat här betyder ingenting i verkligheten.
b) När man kommer fram till ekvivalenspunkten, har all syra som fanns i provet från början, och man får en hastig ökning i pH - här ökar det 5 pH-enheter vid en tillsats av endast 2 ml bas. Du har läst av punkten, men tolkat den fel.
c) Eftersom b blev fel blev c också fel. Det fanns lika många mol syra i 10 ml myrsyra som det fanns mol hydroxidjoner i den titrator som tillsatts vid ekvivalenspunkten.
Jag är med för c), youhou! Ekvivalenspunkten ger volymen som man läser från x-axel.
Nu ska jag försöka lösa b):an. 25 ml x 0.100 mål/dm^-3 NaOH ger 0.0025 mol NaOH vid ekvivalenspunkt.
Concentration HCOOH blir isf 0.0025/10ml? Dvs Dvs 0.25 mol/liter?
Tyvärr är jag inte med för vad du skriver i början! Du menar att man använder sig aldrig av den halvekvivalenspunkt i den här uppgift?
Ekvivalenspunkten är när pH skjuter i höjden. Om du inte hade haft en pH-mätare som registrerade förändringen hela tiden, skulle du säkert ha haft en indikator i lösningen, som skulle ha slagit om vid ungefär 25 ml. Det var b-uppgiften.
Halvekvivalenspunkten har man nytta av om man vill bestämma pKa för syran. Ekvivalenspunkten är vid 25 ml, så halvekvivalenspunkten är vid 12,5 ml. Vid 12,5 ml är pH = pKa = 4,75 ungefär. Man har ingen nytta av att veta pH vid 10 ml.
Tack för allt Smaragdalena!



