Beräkna tryck vid jämvikt i slutet system
"Bromine and chlorine react to produce bromine monochloride according to the equation:
Br2 (g) + Cl2 (g) <--> 2 BrCl (g)
0.2 mol of bromine gas and 0.2 mol of chlorine gas are introduced into a sealed flask with a volume of 5.0 dm3. Under the conditions of the experiment, K = 36.0. How much BrCl will be present at equilibrium?"
Jag räknade först bara med mol, och det blir rätt svar, men jag förmodar att det är meningen att man ska räkna med aktiviteter istället, d.v.s. tryck. I bokens lösning så skriver de:
"K=(aBrCl(g))2/((aCl2(g))*(aBr2(g)))
aj(g)=pj(g)/p°= xj(g)p/p°
K=(pBrCl(g)/p°)2/((pCl2(g)/p°)*(pBr2(g)/p°)) = (xBrCl (g))2/((xCl2 (g))*(xBr2(g)))"
Där x då är molfraktioner och totaltrycket tas ut av standardtrycket. Bygger inte detta på att man vet att totaltrycket är 1 bar? Eller hur kan man annars stryka totaltrycket och bara räkna med molfraktioner?
Jag vill helst räkna med ett sådant "ICE-table"/start-och jämvikts-schema, för det är det som jag har gjort tidigare, men det gör de inte i boken. Därför funderade jag på om man kan räkna ut partialtrycken på något sätt men eftersom att vi inte vet varken temperatur eller totaltryck så vet jag inte hur jag ska göra...
sund20 skrev:"Bromine and chlorine react to produce bromine monochloride according to the equation:
Br2 (g) + Cl2 (g) <--> 2 BrCl (g)
0.2 mol of bromine gas and 0.2 mol of chlorine gas are introduced into a sealed flask with a volume of 5.0 dm3. Under the conditions of the experiment, K = 36.0. How much BrCl will be present at equilibrium?"
Jag räknade först bara med mol, och det blir rätt svar, men jag förmodar att det är meningen att man ska räkna med aktiviteter istället, d.v.s. tryck. I bokens lösning så skriver de:
"K=(aBrCl(g))2/((aCl2(g))*(aBr2(g)))
aj(g)=pj(g)/p°= xj(g)p/p°
K=(pBrCl(g)/p°)2/((pCl2(g)/p°)*(pBr2(g)/p°)) = (xBrCl (g))2/((xCl2 (g))*(xBr2(g)))"
Där x då är molfraktioner och totaltrycket tas ut av standardtrycket. Bygger inte detta på att man vet att totaltrycket är 1 bar? Eller hur kan man annars stryka totaltrycket och bara räkna med molfraktioner?
Jag vill helst räkna med ett sådant "ICE-table"/start-och jämvikts-schema, för det är det som jag har gjort tidigare, men det gör de inte i boken. Därför funderade jag på om man kan räkna ut partialtrycken på något sätt men eftersom att vi inte vet varken temperatur eller totaltryck så vet jag inte hur jag ska göra...
Eftersom antalet gasmolekyler inte ändras vid reaktionen så spelar totaltrycket ingen roll för jämviktsläget. Du kan räkna med att trycket är P, det kommer ändå att förkortas bort så småningom.
Det borde gå alldeles utmärkt att ställa upp en ICE-tabell, det är vad jag skulle ha gjort.
Smaragdalena skrev:sund20 skrev:"Bromine and chlorine react to produce bromine monochloride according to the equation:
Br2 (g) + Cl2 (g) <--> 2 BrCl (g)
0.2 mol of bromine gas and 0.2 mol of chlorine gas are introduced into a sealed flask with a volume of 5.0 dm3. Under the conditions of the experiment, K = 36.0. How much BrCl will be present at equilibrium?"
Jag räknade först bara med mol, och det blir rätt svar, men jag förmodar att det är meningen att man ska räkna med aktiviteter istället, d.v.s. tryck. I bokens lösning så skriver de:
"K=(aBrCl(g))2/((aCl2(g))*(aBr2(g)))
aj(g)=pj(g)/p°= xj(g)p/p°
K=(pBrCl(g)/p°)2/((pCl2(g)/p°)*(pBr2(g)/p°)) = (xBrCl (g))2/((xCl2 (g))*(xBr2(g)))"
Där x då är molfraktioner och totaltrycket tas ut av standardtrycket. Bygger inte detta på att man vet att totaltrycket är 1 bar? Eller hur kan man annars stryka totaltrycket och bara räkna med molfraktioner?
Jag vill helst räkna med ett sådant "ICE-table"/start-och jämvikts-schema, för det är det som jag har gjort tidigare, men det gör de inte i boken. Därför funderade jag på om man kan räkna ut partialtrycken på något sätt men eftersom att vi inte vet varken temperatur eller totaltryck så vet jag inte hur jag ska göra...
Eftersom antalet gasmolekyler inte ändras vid reaktionen så spelar totaltrycket ingen roll för jämviktsläget. Du kan räkna med att trycket är P, det kommer ändå att förkortas bort så småningom.
Det borde gå alldeles utmärkt att ställa upp en ICE-tabell, det är vad jag skulle ha gjort.
Ska förändringen, x, då vara molfraktioner istället för tryck? Typ såhär:
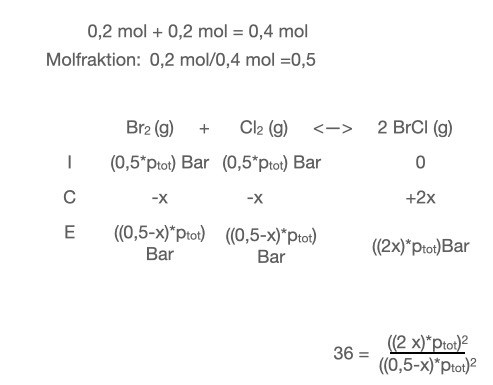
Nej, räkna med mol, dela sedan med volymen. Visa hur det blir!
Smaragdalena skrev:Nej, räkna med mol, dela sedan med volymen. Visa hur det blir!
Alltså att i ICE-tabellen ska det bara vara mol? Och sen delar jag med volymen när jag sätter in det i jämviktsutrycket? Eller när jag har löst ut vad x är?
Om jag sätter in mol istället så blir det ju såhär:
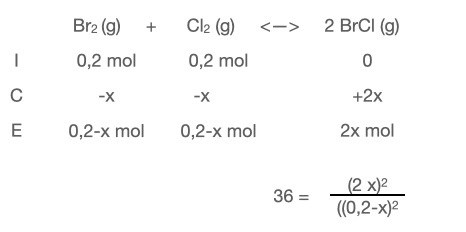 Var/när ska jag dela med volymen? Och vad är det jag skriver uttryck för då, p/RT?
Var/när ska jag dela med volymen? Och vad är det jag skriver uttryck för då, p/RT?
Om jag ska göra det i jämviktsuttrycket så blir det väl såhär:
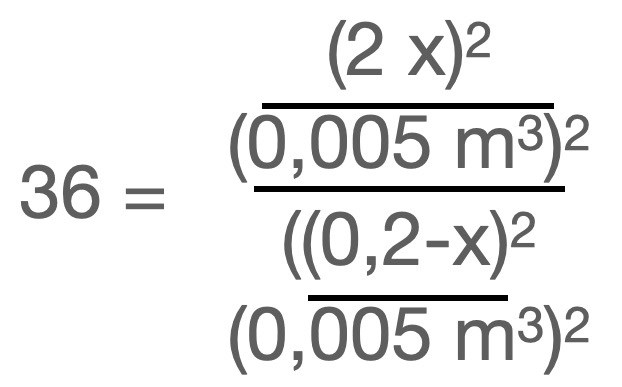
sund20 skrev:Smaragdalena skrev:Nej, räkna med mol, dela sedan med volymen. Visa hur det blir!
Alltså att i ICE-tabellen ska det bara vara mol? Och sen delar jag med volymen när jag sätter in det i jämviktsutrycket? Eller när jag har löst ut vad x är?
Om jag sätter in mol istället så blir det ju såhär:
Var/när ska jag dela med volymen? Och vad är det jag skriver uttryck för då, p/RT?
Om jag ska göra det i jämviktsuttrycket så blir det väl såhär:
Ja. Som du ser kan du förkorta bort volymen.
Smaragdalena skrev:sund20 skrev:Smaragdalena skrev:Nej, räkna med mol, dela sedan med volymen. Visa hur det blir!
Alltså att i ICE-tabellen ska det bara vara mol? Och sen delar jag med volymen när jag sätter in det i jämviktsutrycket? Eller när jag har löst ut vad x är?
Om jag sätter in mol istället så blir det ju såhär:
Var/när ska jag dela med volymen? Och vad är det jag skriver uttryck för då, p/RT?
Om jag ska göra det i jämviktsuttrycket så blir det väl såhär:
Ja. Som du ser kan du förkorta bort volymen.
Okej tack!!!
Men om man vet om totaltrycket och antal mol av reaktanter, går det bra att räkna med partialtrycken då? T.ex. den här frågan som är liknande (vet inte om jag kan ställa den här i samma tråd men annars får jag flytta den till en ny tråd):
CO (g) + H2O (g) <--> CO2 (g) + H2 (g)
K=3,145846449
T=798 K
Totaltryck: 0,1 bar
1 mol CO, 1 mol H2O
--> beräkna substansmängden CO och H2O vid jämvikt.
Jag antar att man skulle kunna göra på samma sätt som i den andra uppgiften så att man inte räknar med trycket (fast nu har man ju inte volymen men man skulle kanske kunna förkorta bort trycket ändå) så att man bara räknar med mol, men det borde väl gå att räkna med tryck också? För jag försökte göra det (se nedan), men får fel svar.

Kan man inte göra på det här sättet eller är det jag som gör fel rent matematiskt?
Kan du lägga upp en bild av den nya uppgiften, så att jag kan se exakt hur uppgiften är formulerad?
Även i den här uppgiften är antalet mol gas totalt oförändrad vid reaktionen, så det är onödigt att krångla till det - det funkar att räkna med substansmängderna.
(Eftersom man vet att det var två mol gas från början - om jag gissar rätt från dina knapphändiga anteckningar - så går det att räkna ut reaktionskärlets volym med idealgaslagen.)
Smaragdalena skrev:Kan du lägga upp en bild av den nya uppgiften, så att jag kan se exakt hur uppgiften är formulerad?
Även i den här uppgiften är antalet mol gas totalt oförändrad vid reaktionen, så det är onödigt att krångla till det - det funkar att räkna med substansmängderna.
(Eftersom man vet att det var två mol gas från början - om jag gissar rätt från dina knapphändiga anteckningar - så går det att räkna ut reaktionskärlets volym med idealgaslagen.)
Såhär är uppgiften formulerad:
"Betrakta reaktionen:
CO (g) + H2O (g) <--> CO2 (g) + H2 (g)
a) Beräkna, med hjälp av data från tabellsamlingen, ändringen i Gibbs fria energi och jämviktskonstanten K vid 798 K.
b) 1 mol CO(g) och 1 mol H2O (g) pumpas in i en behållare vid 798 K och totaltrycket 0,1 bar. Beräkna antalet mol av de olika gaserna efter att jämvikt inställt sig."
I a-uppgiften fick jag att K=3,145846449 och det var rätt.


