Beräkning järn

Vet inte vart jag ska börja från för att lösa lösningen. Har själv börjat räkna ut både järns och rost substansmängd, molmassa och massa. Men vet ej om det är en rätt start. Men även om massan av FeOOH är 433g eller om jag ska utgår från Fe substansmängd för att räkna ut substansmängden av FeOOH. Jag gissar även på att jag måste använda Avogadros konstant för att räkna ut antalet järnmolekyler.
Min egna ”lösning”:
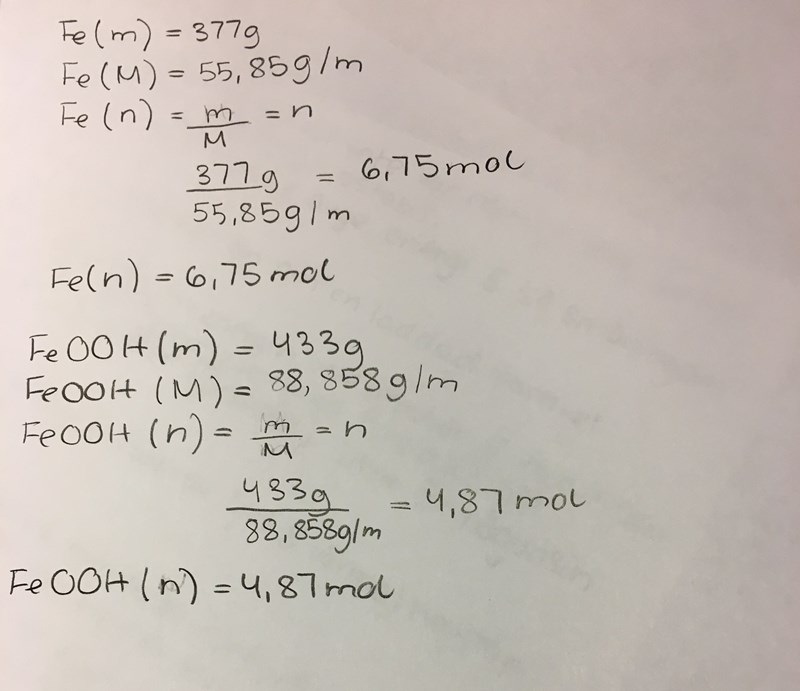
Hur ska jag fortsätta/börja om?
När blecket har rostat, består det av x mol FeOOH och 6,75-x mol Fe. Vilken massa har x mol FeOOH? Vilken massa har 6,75-x mol Fe? Du vet att rosten och järnet sammanlagt har massan 433 g. Kommer du vidare?
Var kommer uppgiften ifrån!? Skandalöst att en uppgiftsförfattare kallar något för järnmolekyler! Järn bildar inte molekyler i sitt rena tillstånd, och knappt i något annat fall heller.
Teraeagle skrev:Var kommer uppgiften ifrån!? Skandalöst att en uppgiftsförfattare kallar något för järnmolekyler! Järn bildar inte molekyler i sitt rena tillstånd, och knappt i något annat fall heller.
Det håller jag vekligen med om!



