bestämning av pKa för ättiksyra
Hej!
Jag har utfört en titreringslaboration där jag skulle bestämma pKa för ättiksyra. Titratorn är NaOH.
Jag ska bestämma pKa och Ka utifrån titreringskurvan och även beräkna med "vanliga" kemiska beräkningar. Kan någon kolla så att jag har gjort rätt? Läser nämligen kursen på distans.
Reaktion: (Molförhållande 1:1 hela reaktionen)
v(NaOH)=50ml
c(NaOH)=
v(HAc)=40ml
Halvtiterpunkt: 11 ml titrator, pH:4,57
Ekvivalenspunkt: 22 ml titrator, pH:6,9
Metod 1 (egen titreringskurva - pH vid halvtiterpunkt):
Metod 2 (beräkning):
v(NaOH)=50ml=
v(NaOH)ekv.punkt=22ml=
c(NaOH)=0,100M
n(NaOH)=
n(NaOH)=n(HAc)
v(HAc)=40ml=
n(HAc)=0,0022mol
c(HAc)=
Ättiksyrans pH från start: 2,96
Jag tror att det blev lite off Ka-värde ur metod 1 pga diverse felkällor vi som laboranter gjorde. Vi kan ha kalibrerat otillräckligt, tillsatt för mkt/för lite titrator, osv. Kan detta stämma? Sorry för långt inlägg!
Nånting är fel med din avläsning av titrerkurvan. Det hade underlättat ifall du kan ladda upp en bild av den här i forumet.
Ättiksyra är en svag syra. Det innebär att den har en ekvivalenspunkt som ligger över pH 7, dvs på den basiska sidan. Du har läst av ekvivalenspunkten vid ett pH som ligger strax under neutralt värde. Hur gjorde du när du läste av det värdet?
I övrigt verkar du ha tänkt och räknat rätt, förutsatt att du har slagit rätt på miniräknaren.
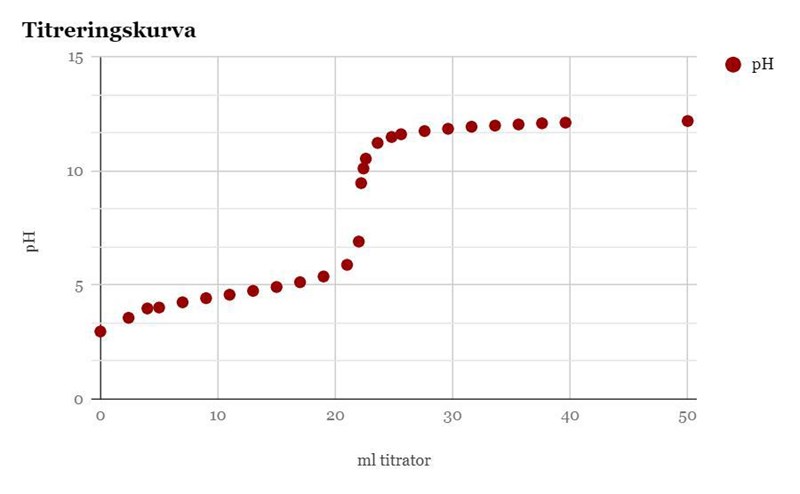
Detta är min titreringskurva. Jag bad min lärare kolla på våra värden och han ansåg att ekvivalenspunkten låg vid pH 6,9. Jag håller dock med dig Teraeagle, det är inte rimligt därför att lösningen blir svagt basisk vid ekvivalenspunkten, dvs får ett pH-värde över 7. Är det bättre att påstå att ekviv.punkten är vid pH 9,46 (22,2 ml titrator)?
Rita om titrerkurvan med vettig gradering på axlarna, den du har är omöjlig att läsa av.
Smaragdalena skrev:Rita om titrerkurvan med vettig gradering på axlarna, den du har är omöjlig att läsa av.
Jag kan väl tycka att det där var lite hårt skrivet, Smaragdalena. Men här är min nya titrerkurva.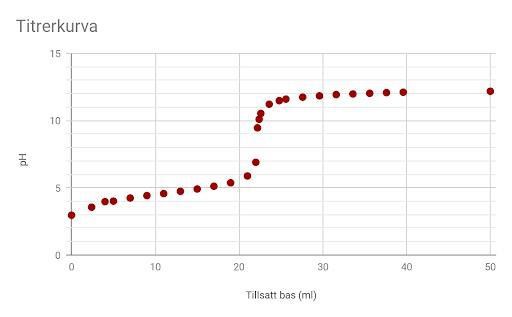
Fortfarande nästan lika svåravläst. Nu har du en vettig pH-skala, men det behövs lodräta streck vid åtminstone varje hel ml för att man skall kunna läsa av volymen vid ekvivalenspunkten.
Lästre ni inte av byretten när pH slog om?
.jpg?width=800&upscale=false) Är det mer korrekt att påstå att ekvivalenspunkten är vid pH 9,46 snarare än 6,9? Som sagt, enligt vår lärare var ekvivalenspunkten vid pH 6,9, men det ifrågasätter jag nu i efterhand.
Är det mer korrekt att påstå att ekvivalenspunkten är vid pH 9,46 snarare än 6,9? Som sagt, enligt vår lärare var ekvivalenspunkten vid pH 6,9, men det ifrågasätter jag nu i efterhand.
Ekvivalenspunkten ser ut att vara vid 22 ml precis. Det är meningslöst att försöka mäta pH där (däremot kan du räkna ut det med hjälp av ditt Ka-värde, om du vill.)
Ekvivalenspunkten läser man av i mitten av "hoppet". Den ser ut att ligga vid ett pH på ca 8,3 samt 22 ml tillsats. Om din lärare säger att ekvivalenspunkten ligger vid pH 6,9 baserat på den kurvan så har den personen fel och borde själv se orimligheten i att det är ett surt pH.




