Bindningsenergier/entalpi
Hej!
Har sett denna fråga på flera olika trådar:
Jag har 3 förbränningar med balanserade reaktioner:
Butan: 2C4H10 (g) + 13O2 (g) = 8CO2 (g) + 10H2O (g) + energi ΔH= -2877 kJ
Kol: C (s) + O2 (g) → CO2 (g) + energi ΔH= -394 kJ
Etanol: C2H5OH (aq) + 3O2 (g) → 2CO2 (g) + 3H2O (l) + energi ΔH= -1646 kJ
b) Vilken av dina 3 reaktioner ger mest energi och vilken ger minst. Beräkna och motiverar med hjälp av bindningsenergier eller entalpier ur tabeller.
På andra trådar har jag sett att man beräknat detta genom att beräkna molekylernas bindningsenergier.
Är det fel att beräkna bildningsenergin istället? I frågan står det att det kan beräknas med bindningsenergier eller entaliper ur tabeller. Exempelvis Butan: 2C4H10 (g) + 13O2 (g) = 8CO2 (g) + 10H2O (g
CO2 = -394
H2O = -286
C4H10 = -2877
Butan före: -2877
Butan efter: 8*-394 + 10*-286 = -6012
Går det att beräkna på detta sätt? Känns betydligt enklare än att beräkna molekylernas bindningar.
Tacksam för guidning!
Det står ju att man kan beräkna det med hjälp av entalpier ur tabeller, vilket är precis vad du har gjort, du har bara använt fel ord.
Tack!
Vet inte om jag tänker rätt nu, men jag fick fram nedan:
CO2 = -394
H2O = -286
C4H10 = -2877
C2H5OH = -1367
Kol: -394
Butan före: -2877
Butan efter: 8*-394 + 10*-286 = -6012
ΔH Butan: -6012 – (-2877) = -3135 kJ
Kol före: -394
Kol efter: -394
ΔH Kol: -394 – (-394) = 0 kJ
Etanol före: -1367 + 3*-394 = -2549
Etanol efter: 2*-394 + 3*-286 = -1646
ΔH Etanol: -1646 – (-2549) = 903 kJ
Tänker jag rätt här eller stämmer det att delta h för kol är 0? Stämmer det då att etanol (903kJ)ger mest energi, sedan kol (0 kJ), sedan butan (-3135 kJ) som inte ens avger energi, utan tar energi.
Tacksam för vägledning
Jag förstår inte vad du har räknat ut. Skriv lite mer, så att det går att följa med i hur du tänker.
Exempelvis:
Butan: 2 C4H10 (g) + 13 O2 (g) = 8 CO2 (g) + 10 H2O (g)
Bildningsentalpi före: 2(-2877)+13*0 = ...
Bildningsentalpi efter: b(-394)+10(-286) = ...
ΔH Butan:
Jag har fått fram reaktionsformelerna för butan, kol och etanol.
Butan: 2C4H10 (g) + 13O2 (g) = 8CO2 (g) + 10H2O (g) + energi
Kol: C (s) + O2 (g) → CO2 (g) + energi
Etanol: C2H5OH (aq) + 3O2 (g) → 2CO2 (g) + 3H2O (l) + energi
Och vill nu beräkna hur mycket energi som avges ur reaktionerna.
Jag hämtade bildningsenergierna från denna tabell: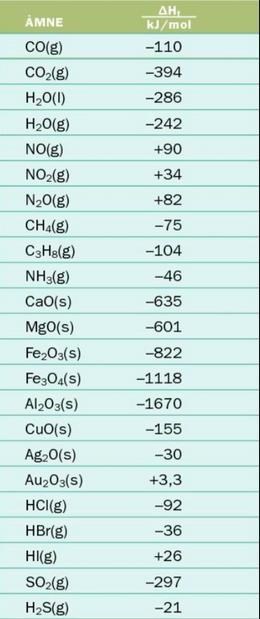 Jag tog värdena och satte in i reaktionsformlerna före och efter, och tar eftervärdet subtraherat med före värdet för att få
Jag tog värdena och satte in i reaktionsformlerna före och efter, och tar eftervärdet subtraherat med före värdet för att få
fram delta H:
Butan före: -2877
Butan efter: 8*-394 + 10*-286 = -6012
ΔH Butan: -6012 – (-2877) = -3135 kJ
Kol före: -394
Kol efter: -394
ΔH Kol: -394 – (-394) = 0 kJ
Etanol före: -1367 + 3*-394 = -2549
Etanol efter: 2*-394 + 3*-286 = -1646
ΔH Etanol: -1646 – (-2549) = 903 kJ
Har jag tänkt rätt? Blir fundersam över att kol blir 0, då värdena är samma före och efter reaktion. Samt eftersom butans delta värde blev negativ. Eller betyder det att reaktionen tar energi istället för att avge?
Tack
Kol före är 0, inte -394. Grundämnena har alltid Hf = 0.
Juste, tack!
Är det rätt tänkt i övrigt?
kol och butan avger ingen energi utan tar då de är negativa, Etanol är den som avger mest energi
Såg att jag tänkte fel i föregående svar
Detta är vad jag kommit fram till:
ΔH Butan: -6012 – (-2877) = -3135 kJ
ΔH Kol: 0 – (-394) = 394 kJ
ΔH Etanol: -1646 – (-2549) = 903 kJ
Alltså etanol avger mest energi, sedan kol.
Stämmer påståendet att förbränning av butan tar energi från omgivningen? Är det rätt att tolka dess negativa värde så?
Om du har fått ett värde som säger att butan behöver ta upp energi för att kunna brinna, så måste du ha räknat fel nånstans.
Varifrån fick du värdet för bildningsentalpi "Butan före: -2877"? Det finns inte i din tabell.
Butans entalpi hämtade jag från denna tabell:
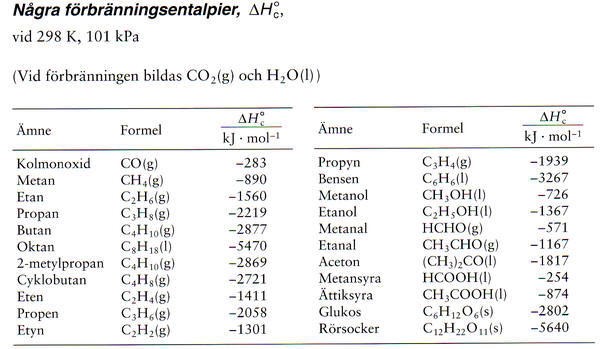
Butan C4H10 = -2877
Ser nu att jag räknat helt fel innan, missat att butan är * 2 samt missat syret.
Butan: 2C4H10 (g) + 13O2 (g) = 8CO2 (g) + 10H2O (g) + energi
2*(-2877) + 13*495 = 681
8*(-394) + 10*(-242) = -5572
ΔH Butan: -5572 - 681 = -6253
Men jag får det fortfarande till ett negativt värde, förstår inte vart jag räknar fel eller vilket värde som är fel?
Storleken på förbränningsentalpin är den värmemängd som frigörs när 1 mol butan brinner i luft/syre, så det är svaret på hela frågan. Värdet är negativt när avgaserna innehåller mindre energi än vad bränslet gjorde.
ΔH Butan: -2877 kJ/mol.
Butan: 2C4H10 (g) + 13O2 (g) = 8CO2 (g) + 10H2O (g) + energi
Eftersom det är 2 mol butan som reagerar, frigörs det 2.2877 kJ. 8 mol CO2 har en bildningsentalpi på 8(-394) kJ. 10 mol vatten har en bildningsentalpi på 10(-242) kJ. Syrgas har bildningsentalpin 0 enligt definitionen. Det frigörs sammanlagt 2.2873+8.394+10.242 kJ = 11 318 kJ d v s 5 659 kJ så bildningsentalpin för butan är 5660 kJ/mol.
Jag får det alltid fel om jag försöker räkna sånt här med tecken, om jag vill få det rätt måste jag tänka typ "energi in och energi ut".
Jaha okej. Låter lite krångligt
Har jag räknat rätt med tecken på kol och Butan?
ΔH Kol: 0 – (-394) = 394 kJ
ΔH Etanol: -1646 – (-2549) = 903 kJ
eller behöver jag tänka ”energi in och energi ut” där med?
ΔH är alltid negativt när ett bränse + syre blir till koldioxid och vatten. Eftersom du har fått positiva värden behöver du tydligen tänka ”energi in och energi ut” där med.
CO2 = -394
H2O = -286
C4H10 = -2877
C2H5OH = -1367
Butan: 2C4H10 (g) + 13O2 (g) = 8CO2 (g) + 10H2O (g) + energi
Butan före förbränning: 2*2877 + 0 = 5754
Butan efter förbränning: 8*394 + 10*242 = 5572
ΔH Butan: 5572 - 5754 = -182 kJ
Värdet är negativt eftersom avgaserna innehåller mindre energi än bränslet
Kol: C (s) + O2 (g) → CO2 (g) + energi ΔH
Kol före förbränning: 0
Kol efter förbränning: 394
ΔH Kol: 394 kJ
Etanol: C2H5OH (aq) + 3O2 (g) → 2CO2 (g) + 3H2O (l) + energi ΔH
Etanol före förbränning: 1367 + 0 = 1367
Etanol efter förbränning: 2*394 + 3*286 = 1646
ΔH Etanol: 1646 - 1367 = 279 kJ
Varför blir ΔH Etanol positiv? Räknar jag fel? För det stämmer inte med bränse + syre blir till koldioxid och vatten.
Ta reda på definitionen för "förbränningsentalpi". Du verkar tro att det är samma sak som bildningsentalpi, men det är det inte. Du har gjort exakt samma fel som för butanet tidigare i den här tråden.
Förbränningsentalpi är den värmemängd som utvecklas när en mol av ett ämne förbränns i syre vid konstant tryck.
Om jag förstår detta rätt så har inte mina uträkningar behövts; jag har skrivit svaret redan i frågan? :
Butan: 2C4H10 (g) + 13O2 (g) = 8CO2 (g) + 10H2O (g) + energi ΔH= -2877 kJ
Kol: C (s) + O2 (g) → CO2 (g) + energi ΔH= -394 kJ
Etanol: C2H5OH (aq) + 3O2 (g) → 2CO2 (g) + 3H2O (l) + energi ΔH= -1646 kJ
Jag tror jag nu förstår vad du menar med att jag räknat ut bildningsentalpi.
Alltså avger kol mest energi, sedan etanol och sedan butan
Tänker jag rätt nu?
Alltså avger kol mest energi, sedan etanol och sedan butan
Tänker jag rätt nu?
Nej. Du borde ange ΔH i enheten kJ/mol, så att man kan jämföra dem med varandra. Och även om det är så att man skall dela ΔH med 2 för butan och etanol så är det butan som ger mest energi, sedan etanol och sist kol - om man räknar per mol, alltså. Om man räknar per kg kan det bli helt annorlunda - men det behävsberäkningar för att man skall kunna se det.
Okej,
Jag förstår varför butan ska delas med 2 eftersom Butan: 2C4H10
Men jag hänger inte med på varför etanol ska delas på 2?
Etanol: C2H5OH (aq) + 3O2 (g) → 2CO2 (g) + 3H2O (l) + energi ΔH= -1646 kJ
Jag vet inte varifrån du har fått den siffran. Enligt tabellen för förbränningsentalpier är ΔH =-1367 kJ/mol för etanol.
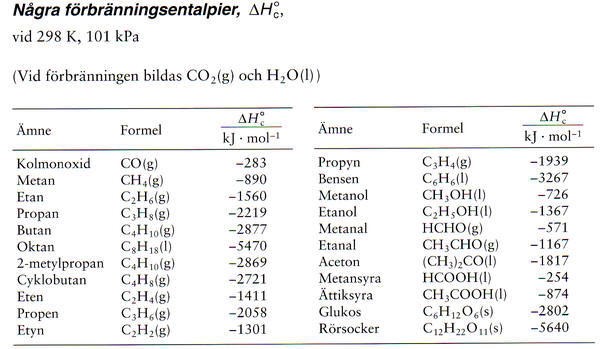
Ja, ser nu att du har rätt.
Etanol behöver väl inte delas på 2?
Jag får det nu till
Butan: -2877/2 = -1438 kJ
Etanol: -1367 kJ
Kol: -394 kJ
Rätt?
Butan skall inte heller delas med 2, om du utgår från förbränningsentalpierna.
Smaragdalena skrev:Alltså avger kol mest energi, sedan etanol och sedan butan
Tänker jag rätt nu?
Nej. Du borde ange ΔH i enheten kJ/mol, så att man kan jämföra dem med varandra. Och även om det är så att man skall dela ΔH med 2 för butan och etanol så är det butan som ger mest energi, sedan etanol och sist kol - om man räknar per mol, alltså. Om man räknar per kg kan det bli helt annorlunda - men det behävsberäkningar för att man skall kunna se det.
Okej så med detta syftade du på när formeln var balanserad då Butan: 2C4H10.
Jag är med nu,
tack så mycket för hjälpen!


